
【題目】丁苯酞(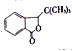 )是國際上首個作用于急性缺血性腦猝中多個病理環節的創新藥物,獲國家科技進步二等獎。丁苯酞的一種合成路線如下:
)是國際上首個作用于急性缺血性腦猝中多個病理環節的創新藥物,獲國家科技進步二等獎。丁苯酞的一種合成路線如下:
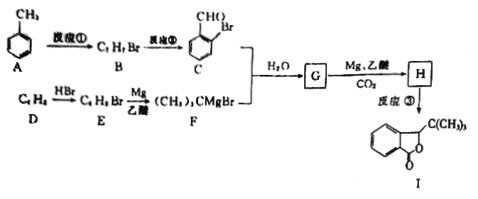
已知: 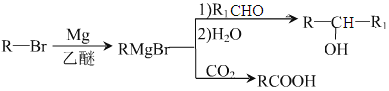
回答下列問題:
(1)H中的含氧官能團的名稱是_____________,I的分子式為_______________。
(2)反應①的試劑,條件為_________________,反應②的類型是_________。
(3)G的結構簡式為______________________。
(4)由D生成E的化學方程式為____________________。
(5)芳香族化合物M(C8H7OBr)含有和C相同的官能團,其核磁共振氫譜有4組峰,且峰面積之比為2:2:2:1,寫出符合條件的所有M的結構簡式:_____________________。
(6)參照上述合成路線,以乙醇為原料(其他試劑任選),設計制備CH3CH2COOCH2CH3的合成路線:_____________________。
【答案】 羥基、羧基 C12H14O2 Br2、鐵粉或FeBr3 氧化反應 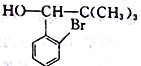
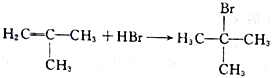
![]()
【解析】本題考查有機物的合成和推斷,(1)根據信息,推出G的結構簡式為: ,根據信息,推出H的結構簡式為:
,根據信息,推出H的結構簡式為: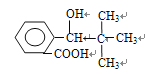 ,H中含有官能團是羥基和羧基,根據有機物成鍵特點,I的分子式為C12H14O2 ;
,H中含有官能團是羥基和羧基,根據有機物成鍵特點,I的分子式為C12H14O2 ;
(2)A與液溴,在鐵作催化劑下發生取代反應,反應②是把甲基氧化成羧基,反應類型為氧化反應;(3)根據上述分析,G的結構簡式為: ;(4)根據F的結構簡式,推出D的結構簡式為CH2=C(CH3)2,D與HBr發生加成反應,Br原子加成到氫原子最少的不飽和碳原子,即反應方程式為:
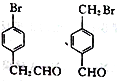
;(4)根據F的結構簡式,推出D的結構簡式為CH2=C(CH3)2,D與HBr發生加成反應,Br原子加成到氫原子最少的不飽和碳原子,即反應方程式為: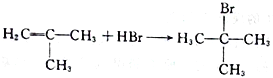 ;(5)M中含有醛基和Br原子,核磁共振氫譜有4組峰,說明有4種不同的氫原子,不同氫原子的個數為2:2:2:1,因此M的結構簡式為
;(5)M中含有醛基和Br原子,核磁共振氫譜有4組峰,說明有4種不同的氫原子,不同氫原子的個數為2:2:2:1,因此M的結構簡式為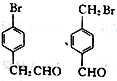 ;(6)目標物質屬于酯,是由CH3CH2COOH和CH3CH2OH通過酯化反應生成,根據題干中合成路線,讓乙醇與HBr發生取代反應,然后CH3CH2Br與Mg、乙醚和CO2反應生成CH3CH2COOH,因此路線為:
;(6)目標物質屬于酯,是由CH3CH2COOH和CH3CH2OH通過酯化反應生成,根據題干中合成路線,讓乙醇與HBr發生取代反應,然后CH3CH2Br與Mg、乙醚和CO2反應生成CH3CH2COOH,因此路線為:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、Z、R、T的原子半徑與原子序數關系如圖所示。R與X能形成X2R、X2R2化合物,Z是地殼中含量最多的金屬元素,T原子最外層電子數是K層電子數的2倍。下列推斷正確的是( )

A. X和Y組成的化合物的水溶液保存在塑料瓶中 B. 原子半徑和離子半徑均滿足:Y<Z
C. 最高價氧化物對應的水化物酸性:Z>T D. 含Z元素的鹽溶液一定顯酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機樣品3.1 g完全燃燒,燃燒后的混合物通入過量的澄清石灰水,石灰水共增重 7. lg,經過濾得到10g沉淀。該有機樣品可能是
A. 甲醇 B. 乙醇 C. 丙三醇 D. 甲醇和丙三醇的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(NA為阿伏加德羅常數)
A.124 g P4含有P—P鍵的個數為4NA
B.12 g石墨中含有C—C鍵的個數為1.5NA
C.12 g金剛石中含有C—C鍵的個數為4NA
D.60gSiO2中含Si—O鍵的個數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組利用如圖裝置探究SO2和Fe(NO3)3溶液的反應原理。回答下列問題:

(1)在實驗室中,欲配制250g70%的濃硫酸,需要的玻璃儀器除量筒、燒杯外,還需要有__________,裝置A中盛放濃硫酸的儀器名稱是___________。
(2)往三頸燒瓶中通入N2的操作在滴加濃硫酸(填“之前”或“之后”),其目的是______________。
(3)三頸燒瓶中發生反應的化學方程式為_____________________,該反應中濃硫酸表現出的性質為______________。
(4)SO2易溶于水,下列裝置可用于C處虛線框內吸收尾氣的是___________(填編號)。
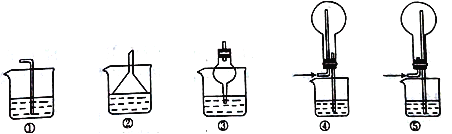
(5)裝置B中產生白色沉淀的原因有兩種可能。若要證明Fe3+能氧化SO2,則需要改進的地方是___________________,改進后若得到肯定結論,則裝置B中發生反應的離子方程式為___________________、____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R是周期表前四周期的五種元素,原子序數依次增大。X原子p軌道上有兩個未成對電子;Y的氣態氫化物能使石蕊試液變藍色;Z的最外層電子數為其內層電子數的3倍;W的價電子排布式為ns(n-1)np2(n-1);R的最外層只有1個電子,次外層有18個電子。
(1)X、Y、Z、W四種元素中電負性最大的是__________(填元素符號),基態R原子的核外電子排布式為______________。
(2)X、Y、Z的最簡單氫化物中,鍵角由大到小的順序為_______________(用氫化物的化學式表示)。
(3)Z、W元素構成的微粒WZ42-的立體構型是________,與WZ42-互為等電子體的一種分子為____(填化學式,任寫一種)。
(4)每個XY-離子中含有________個π鍵。
(5)已知Z、R能形成一種化合物R2Z,其晶胞結構如圖所示。

①該晶胞原子坐標參數A為(0,0,0);B為(1,0,0);C為(![]() ,
, ![]() ,
, ![]() )。則D原子的坐標參數為________,它代表_______(填元素符號)原子。
)。則D原子的坐標參數為________,它代表_______(填元素符號)原子。
②若R2Z晶體密度dg·cm-3,晶胞參數為apm,則阿伏伽德羅常數值NA=______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素R、T、X、Y、Z在元素周期表的相對位置如下表所示,它們的最外層電子數之和為24。則下列判斷正確的是

A. R位于元素周期表中第二周期第VA族
B. R能分別與X、Z形成共價化合物
C. 原子半徑大小順序為X > T > Y
D. Z元素的最高價氧化物對應的水化的化學式為HZO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏伽徳羅常數的數值,下列說法中正確的是
A. lmolNa2O和Na2O2混合物中含有的陰陽離子總數大于3NA
B. 常溫常壓下,20gD2O分子中所含中子數為10NA
C. 50ml12mol·L-1的鹽酸與足量的MnO2共熱轉移的電子數為0.3 NA
D. 密閉容器中2mol NO和Imol的O2,充分反應,產物的分子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇又稱“木精”,是非常重要的化工原料。
(1)CO和H2在高溫、高壓、催化劑條件下反應可制備甲醇。根據下表中相關化學鍵鍵能(鍵能是斷裂1mol化學鍵時需要吸收的能量,或形成1mol化學鍵時釋放的能量)數據,寫出CO(CO分子中含有C=O)和H2反應生成甲醇的熱化學方程式______。
化學鍵 | H-H | O-H | C-H | C-O | C=O |
鍵能/KJ·mol-1 | 436 | 463 | 413 | 351 | 1076 |
(2)甲醇脫氫可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。
HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。

①該脫氫反應的ΔH___0(填“>”、“<”或“=”)
②600K時,Y點甲醇的V(正)___V(逆)(填“>”、“<”或“=”),判斷依據是_____
③下列敘述不能說明該脫氫反應已經達到平衡狀態的是_____。
A.c(CH3OH)=c(HCHO) B.HCHO的體積分數保持不變
C.V正(CH3OH)=V逆(HCHO) D.混合氣體平均分子量保持不變
(3)一定條件下,甲醇與一氧化碳反應可以合成乙酸。已知:常溫下,弱電解質的電離平衡常數:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13。
常溫下,將20mL0.10mol·L-1CH3COOH溶液和20mL0.10mol·L-1HSCN溶液分別與20mL0.10mol·L-1NaHCO3溶液混合,實驗測得產生CO2氣體體積V隨時間t變化的示意圖如下圖所示:

①反應初始階段,兩種溶液產生CO2氣體的速率存在明顯差異的原因是_______,反應結束后所得兩溶液中,C(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)。
②常溫條件下,將amol·L-1的CH3COOH與bmol·L-1Ba(OH)2溶液等體積混合,反應平衡時,2c(Ba2+)=c(CH3COO-),用含a和b的代數式表示該混合溶液中醋酸的電離常數為_______。
(4)甲醇燃料電池可能成為未來便攜電子產品應用的主流。某種甲醇燃料電池工作原理如圖所示,則通入a氣體電極的電極反應式為___________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com