
【題目】阿明洛芬屬于苯丙氨酸類抗炎藥。鎮(zhèn)痛效果優(yōu)于布洛芬。如圖是阿明洛芬的一條合成路線。
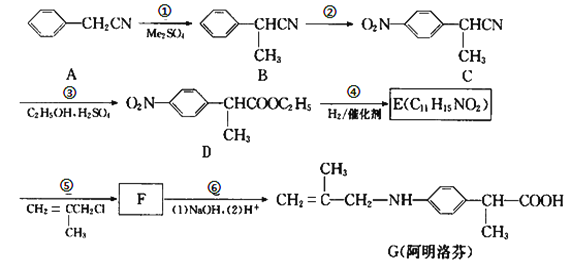
(1)反應①為取代反應,該步反應物Me2SO4中的“Me”表示___,D中官能團的名稱是__。
(2)寫出E的結構簡式___。
(3)寫出B到C這步反應的化學方程式___。
(4)G不能發(fā)生的反應類型是_____(填字母序號)。
A.水解反應 B.酯化反應 C.還原反應 D.加聚反應 E.縮聚反應
(5)寫出F在NaOH溶液中反應的化學方程式_____。
(6)寫出所有滿足下列條件的B的同分異構體____。
①只含有一個環(huán)(即苯環(huán))的芳香族化合物;
②核磁共振氫譜中氫峰的個數相比B的其它同分異構體最少。
【答案】-CH3 硝基、酯基 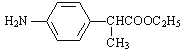
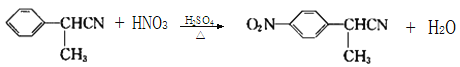 A
A 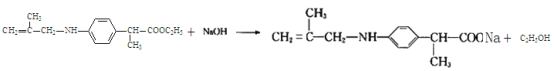
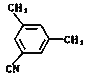 、
、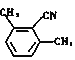 ;
;
【解析】
(1)反應①為取代反應,碳鏈骨架不變,則-CH2CN中1個-H原子被-CH3取代;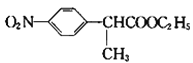 中官能團是-NO2、-COO-;
中官能團是-NO2、-COO-;
(2) 與氫氣發(fā)生發(fā)生還原反應生成E,根據E的分子式可知,
與氫氣發(fā)生發(fā)生還原反應生成E,根據E的分子式可知, 中的硝基被還原成氨基;
中的硝基被還原成氨基;
(3)B到C是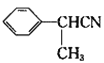 發(fā)生硝化反應生成
發(fā)生硝化反應生成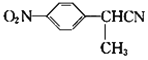 ;
;
(4)結合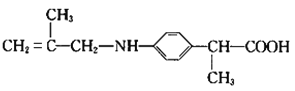 含有的官能團碳碳雙鍵、羧基分析;
含有的官能團碳碳雙鍵、羧基分析;
(5)E→F發(fā)生取代反應,-NH2中的-H被CH2=C(CH3)CH2-取代,F是![]() ;
;
(6)只含有一個苯環(huán),核磁共振氫譜中氫峰的個數相比B的其它同分異構體最少,要求結構對稱。
(1)反應①為取代反應,碳鏈骨架不變,則-CH2CN中1個-H原子被-CH3取代,則反應物Me2SO4中的“Me”表示甲基(-CH3);
 中官能團是-NO2、-COO-,名稱是硝基、酯基;
中官能團是-NO2、-COO-,名稱是硝基、酯基;
(2) 與氫氣發(fā)生發(fā)生還原反應生成E,根據E的分子式可知,
與氫氣發(fā)生發(fā)生還原反應生成E,根據E的分子式可知, 中的硝基被還原成氨基,E的結構簡式是
中的硝基被還原成氨基,E的結構簡式是 ;
;
(3)B到C是 發(fā)生硝化反應生成
發(fā)生硝化反應生成 ,反應方程式是
,反應方程式是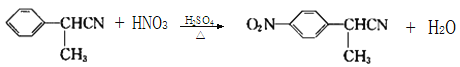 ;
;
(4) 含有的官能團碳碳雙鍵,能發(fā)生還原反應、加聚反應,含有羧基可以發(fā)生酯化反應,
含有的官能團碳碳雙鍵,能發(fā)生還原反應、加聚反應,含有羧基可以發(fā)生酯化反應,![]() 脫H、-COOH脫-OH發(fā)生縮聚反應,所以不能發(fā)生水解反應,故選A;
脫H、-COOH脫-OH發(fā)生縮聚反應,所以不能發(fā)生水解反應,故選A;
(5)E→F發(fā)生取代反應,-NH2中的-H被CH2=C(CH3)CH2-取代,F是![]() ,
,![]() 在NaOH溶液中發(fā)生水解反應,反應方程式是
在NaOH溶液中發(fā)生水解反應,反應方程式是 ;
;
(6)只含有一個苯環(huán),核磁共振氫譜中氫峰的個數最少,符合條件的B的同分異構體是 和
和 ;
;


科目:高中化學 來源: 題型:
【題目】鐵和鈷是兩種重要的過渡元素。請回答下列問題:
(1)鈷在元素周期表中的位置是___________,其基態(tài)原子的價電子排布圖為___________。
(2)FeCO3是菱鐵礦的主要成分,其中C原子的雜化方式為________;分子中的大π鍵可用符號Π![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為Π![]() ),則CO32-中的大π鍵應表示為________。
),則CO32-中的大π鍵應表示為________。
(3)已知Fe2+半徑為61pm,Co2+半徑為65pm,在隔絕空氣條件下分別加熱FeCO3和CoCO3,實驗測得FeCO3受熱分解溫度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是鈷的一種配合物,向含0.01mol該配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。則該配合物的配位數為_____。
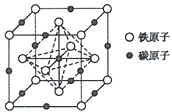
(5)奧氏體是碳溶解在r-Fe中形成的一種間隙固溶體,無磁性,其晶胞為面心立方結構(如圖所示),則該晶體中與鐵原子距離最近的鐵原子數目為___________;若該晶胞參數為a pm,則該晶體的密度為___________g·cm-3(阿伏加德羅常數的值用NA表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、X均為中學化學常見物質,一定條件下它們有如圖所示轉化關系(部分產物已略去)。下列說法正確的是( )
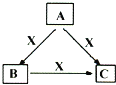
A. 若X為KOH溶液,則A可能為Al
B. 若X為Fe,則C可能為Fe(NO3)2溶液
C. 若A、B、C均為焰色反應呈黃色的化合物,則X一定為CO2
D. 若X為O2,則A可為有機物乙醇,也可為非金屬單質硫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某銅器表面Cux(OH)yClz(Cu為+2價,x、y、z為正整數)的組成,現進行如下實驗:取少量Cux(OH)yClz,將其完全溶解于稀硝酸中,將所得溶液分成兩等份。向其中一份滴加足量AgNO3溶液,將所得沉淀過濾、洗滌、干燥,得到固體0.1435 g。向另一份中加入0.1000 mol·L1 EDTA(已知Cu2+與EDTA反應的化學計量數比為1∶1),恰好完全反應時消耗EDTA 20mL。則Cux(OH)yClz的化學式中y的值為( )
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】七鋁十二鈣(12CaO·7Al2O3)是新型的超導材料和發(fā)光材料,用白云石(主要含CaCO3)和鋁礦渣(主要含Al2O3和SiO2)制備七鋁十二鈣的工藝如下:
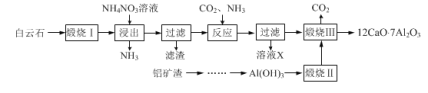
已知“煅燒Ⅲ”時發(fā)生反應為:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑
12CaO·7Al2O3+12CO2↑
(1)寫出“浸出”過程中CaO與NH4NO3溶液反應的化學方程式:___。
(2)檢驗“浸出”過程中有NH3生成的方法是:___。
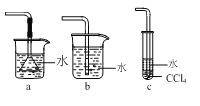
(3)如圖所示裝置中可用于實驗室吸收NH3的是___(填字母)。
(4)溶液X中所含主要溶質的化學式為____。
(5)設計由鋁礦渣制取Al(OH)3的方法,并簡述過程:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據Mg能在CO2中燃燒,某興趣小組推測Na應該也能在CO2中燃燒,且固體產物可能為C、Na2O和Na2CO3中的兩種或三種。該小組用如下圖裝置進行了實驗探究。已知PdCl2能被CO還原得到黑色的Pd。
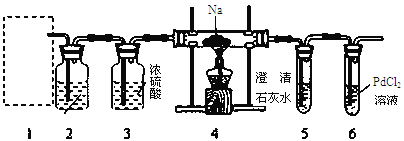
回答下列問題:
(1)為了使反應隨開隨用,隨關隨停,上圖虛線方框內應選用____裝置(填下圖字母代號),如何檢驗所選裝置的氣密性_____。
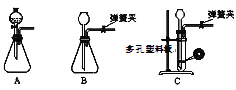
(2)裝置2中所盛試劑為_______。
A.NaOH溶液 B.飽和NaHCO3溶液
C.飽和Na2CO3溶液 D.飽和NaCl溶液
(3)檢測裝置的氣密性完好并裝好藥品后,在點燃酒精燈前應先進行裝置1中的反應操作,待觀察到_____現象時,再點燃酒精燈,這步操作的目的是________。
(4)由實驗現象和進一步的探究得出反應機理。
A.裝置6中有黑色沉淀生成;
B.取反應后直玻管中的固體物質23.0g溶于足量的水中,無氣泡產生且得到澄清的溶液;將溶液加水稀釋配成250 mL的溶液;
C.取25.00ml步驟B的溶液,滴加足量BaCl2溶液,將生成的白色沉淀過濾、洗滌、干燥,稱量得固體質量為1.97g。
①步驟C中不溶物干燥前必須經過洗滌,如何檢驗該沉淀是否洗滌干凈____。
②該探究得出鈉與二氧化碳反應的化學方程式為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個密閉容器中,分別充有質量相同的甲、乙兩種氣體,若兩容器的溫度和壓強均相同,且甲的密度大于乙的密度,則下列說法正確的是( )
A.甲的分子數比乙的分子數多
B.甲的摩爾體積比乙的摩爾體積小
C.甲的相對分子質量比乙的相對分子質量小
D.甲的物質的量比乙的物質的量少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)6.02×1023個氫氧根離子的物質的量是________mol,其摩爾質量為________。
(2)在標準狀況下,0.01mol某氣體的質量為0.44g,則該氣體的密度為________g·L-1(保留小數點后兩位),該氣體的相對分子質量為________。
(3)將4g NaOH固體溶于水配成250mL溶液,此溶液中NaOH的物質的量濃度為______;取出10mL此溶液,將此10mL溶液加水稀釋到100mL,稀釋后溶液中NaOH的物質的量濃度為______。
(4)硫通常是一種淡黃色晶體,它的蒸氣有橙色、無色、紅棕色等多種,它們都是硫的單質,但是每個分子中硫原子的個數不同,可用Sx表示,對下列蒸氣測定的結果是:無色蒸氣的密度是同狀況下氫氣密度的64倍,則它的分子式為:______。
(5)把18.0mol/L的濃硫酸稀釋成2.00mol/L的稀硫酸100mL,下列操作對所配溶液濃度造成的后果,屬于“偏低”的是______________
①未洗滌稀釋過濃硫酸的小燒杯;
②使用經蒸餾水洗滌后未干燥的小燒杯稀釋濃硫酸;
③加水時不慎超過了刻度線,又將超出部分用吸管吸出;
④配溶液用的容量瓶用蒸餾水洗滌后未經干燥;
⑤定容時俯視刻度;
⑥倒轉容量瓶搖勻后,液面降至刻度線下,再加水至刻度。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有金屬單質A、B、C和氣體甲、丙以及物質D、E、F、G、H,它們之間的相互轉化關系如圖所示(圖中有些反應的生成物和反應條件沒有標出)。
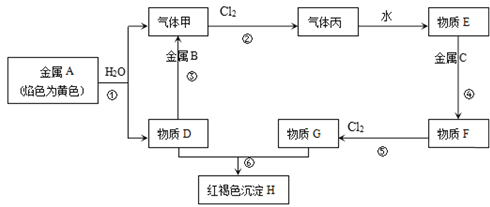
請回答下列問題:
(1)寫出下列物質的化學式:B___、丙____;
(2)寫出下列反應的離子方程式:
反應③_____;
反應⑤_____;
(3)向F的溶液中加入D溶液后產生的現象是____,用化學反應方程式解釋產生此現象的原因____、___。
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com