
【題目】下列物質的制備中,不符合工業生產實際的是
A.NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
B.濃縮海水![]() Br2
Br2![]() HBr
HBr ![]() Br2
Br2
C.飽和食鹽水![]() Cl2
Cl2![]() 漂白粉
漂白粉
D.H2和Cl2混合氣體![]() HCl氣體
HCl氣體![]() 鹽酸
鹽酸
【答案】D
【解析】
A.工業上制備硝酸是通過氨的催化氧化生成NO后,生成的NO與O2反應生成NO2,NO2溶于水生成HNO3,A項不符合題意,不選;
B.通過海水提取溴,是用Cl2氧化經H2SO4酸化的濃縮海水,將其中的Br-氧化為Br2,通過熱空氣和水蒸氣吹入吸收塔,用SO2將Br2轉化為HBr,再向吸收塔內通入Cl2氧化為Br2,經CCl4萃取吸收塔中的Br2得到,B項不符合題意,不選;
C.工業生產中用直流電電解飽和食鹽水法制取氯氣,通過氯氣和石灰乳(即Ca(OH)2)制得漂白粉,C項不符合題意,不選;
D.H2和Cl2混合氣體在光照條件下會劇烈反應,發生爆炸,不適合工業生產,D項符合題意;
答案選D。


 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.2-丁烯不存在順反異構體
B.已知丙烷的二氯代物有四種異構體,則其六氯代物的異構體數目為六種
C.菲的結構簡式為 ,它與硝酸反應,可生成4種一硝基取代物
,它與硝酸反應,可生成4種一硝基取代物
D.乙醛的核磁共振氫譜中有二個峰,峰面積之比是1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氧化鉬(MoO3)是石油工業中常用的催化劑,也是搪瓷釉藥的顏料,該物質常使用輝鉬礦(主要成分
為MoS2)通過一定條件來制備。回答下列相關問題:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
則2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代數式表示)。
(2)若在恒溫恒容條件下僅發生反應MoS2(s)Mo(s)+S2(g)
①下列說法正確的是______(填字母)。
a.氣體的密度不變,則反應一定達到了 平衡狀態
b.氣體的相對分子質量不變,反應不定處于 平衡狀態
c.增加MoS2的量,平衡正向移動
②達到平衡時S2(g)的濃度為1.4 molL-1,充入一定量的S2(g),反應再次達到平衡,S2(g)濃度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密閉容器中充入1.0 molS2(g)和1.5 mol O2(g),若僅發生反應:S2(g)+2O2(g)2SO2(g),5 min后反應達到平衡,此時容器壓強為起始時的80%,則0~5 min內,S2(g)的反應速率為______molL-1min-1。
(4)在恒容密閉容器中,加入足量的MoS2和O2,僅發生反應:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.測得氧氣的平衡轉化率與起始壓強、溫度的關系如圖所示:
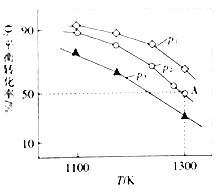
①△H______(填“>“*<“或“=“)0;比較p1、p2、p3的大小:______
②若初始時通入7.0molO2,p2為7.0 kPa,則A點平衡常數Kp=______(用氣體平衡分壓代替氣體平衡濃度計算。分壓=總壓×氣體的物質的量分數,寫出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙氣(主要污染物SO2、NOX)經O3預處理后用CaSO3水懸浮液吸收,可減少煙氣中的SO2、NOx 的含量。
(1) O3氧化煙氣中SO2、NOx 的主要反應的熱化學方程式為: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。則2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。則2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃時,利用測壓法在剛性反應器中,投入一定量的NO2發生反應3NO2(g)![]() 3NO(g)+O3(g),體系的總壓強 p隨時間 t的變化如下表所示:
3NO(g)+O3(g),體系的總壓強 p隨時間 t的變化如下表所示:
反應時間/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
壓強/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反應溫度,則平衡后體系壓強 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 時,反應物的轉化率 α=______。
③T℃時反應3NO2(g)![]() 3NO(g)+O3(g)的平衡常數Kp=____________(Kp 為以分壓表示的平衡常數,分壓等于總壓乘以該氣體的物質的量分數)
3NO(g)+O3(g)的平衡常數Kp=____________(Kp 為以分壓表示的平衡常數,分壓等于總壓乘以該氣體的物質的量分數)
(3)T℃時,在體積為2L的密閉剛性容器中,投入2 mol NO2發生反應2NO2(g)![]() 2NO(g)+O2(g),實驗測得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆為速率常數,受溫度影響。在溫度為T℃時NO2的轉化率隨時間變化的結果如圖所示(反應在5.5min時達到平衡):
2NO(g)+O2(g),實驗測得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆為速率常數,受溫度影響。在溫度為T℃時NO2的轉化率隨時間變化的結果如圖所示(反應在5.5min時達到平衡):

①在體積不變的剛性容器中,投入固定量的NO2發生反應,要提高NO2轉化率,可采取的措施是______________、___________。
②由圖中數據,求出該反應的平衡常數為_________。
③計算A 點處v正/v逆=_________________________(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用濃鹽酸與濃硫酸混合快速制取HCl.下列解釋合理的是( )
A.濃硫酸是高沸點的酸,通過它與濃鹽酸反應制取低沸點的酸
B.通過改變溫度和濃度等條件,利用平衡移動原理制取HCl
C.兩種強酸混合,溶解度會相互影響,低溶解度的物質析出
D.濃硫酸的濃度遠大于濃鹽酸的濃度,高濃度的酸制取低濃度的酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素原子半徑與原子序數的關系圖。字母代表元素,分析正確的是
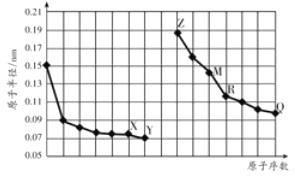
A. R在周期表的第15列
B. Y、Q兩種元素的氣態氫化物及其最高價氧化物的水化物均為強酸
C. 簡單離子的半徑:X>Z>M
D. Z的單質能從M與Q元素構成的鹽溶液中置換出單質M
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據事實,寫出下列反應的熱化學方程式。
(1)在25℃、101kPa下,1g甲醇燃燒生成CO2和液態水時放熱22.68kJ。則表示甲醇燃燒熱的熱化學方程式為____________
(2)若適量的N2和O2完全反應,每生成23克NO2需要吸收16.95kJ熱量____________
(3)已知拆開1molH-H鍵,1molN-H鍵,1molN≡N鍵分別需要的能量是436kJ、391kJ、946kJ,則N2與H2反應生成NH3的熱化學方程式為____________
(4)根據圖像,寫出反應的熱化學方程式:
① ____________
____________
②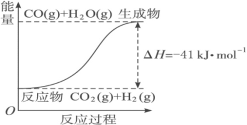 ____________
____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】.為探究銅與稀硝酸反應的氣態產物中是否含NO2,進行如下實驗。
已知: FeSO4+NO→[Fe(NO)]SO4,該反應較緩慢,待生成一定量[Fe(NO)]2+時突顯明顯棕色。

(1)實驗前需檢驗裝置的氣密性,簡述操作_____________________________________。
(2)實驗開始時先將Y形試管向盛有碳酸鈣的支管傾斜,緩慢滴入稀硝酸,該實驗操作的目的是__________________________________________________________________;銅片和稀硝酸反應的化學方程式為________________________________。
(3)洗氣瓶中加入KSCN溶液的目的及原理是______________________________________;本實驗只觀察到洗氣瓶中出現了棕色,寫出尾氣處理的化學方程式________________。
.實驗室制備的CuSO4·5H2O中常含Cu(NO3)2,用重量法測定CuSO4·5H2O的含量。
(4)實驗步驟為:①___________②加水溶解③加氯化鋇溶液,沉淀④過濾(其余步驟省略),在過濾前,需要檢驗是否沉淀完全,其操作是_________________________________。
(5)若1.040 g試樣中含CuSO4·5H2O的準確值為1.015 g,而實驗測定結果是l.000 g 測定的相對誤差為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加熱聚丙烯廢塑料可以得到碳、氫氣、甲烷、乙烯、丙烯、苯和甲苯。用如圖所示裝置探究廢舊塑料的再利用。下列敘述不正確的是
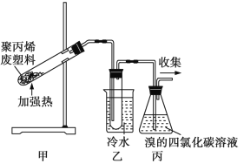
A.裝置乙試管中收集到的液體在催化劑存在下可以與Br2發生取代反應
B.裝置丙中的試劑吸收反應產生的氣體后得到的產物的密度均比水大
C.最后收集的氣體可以作為清潔燃料使用
D.甲烷的二氯代物有2種
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com