
【題目】硫酸亞鐵(FeSO4·7H2O)是一種重要的食品和飼料添加劑。實驗室通過如下實驗由廢鐵屑制備FeSO4·7H2O晶體:
①將5%Na2CO3溶液加入到盛有一定量廢鐵屑的燒杯中,加熱數分鐘,用傾析法除去Na2CO3溶液,然后將廢鐵屑用水洗滌2~3遍;
②向洗滌過的廢鐵屑中加入過量的稀硫酸,控制溫度在50~80℃之間至鐵屑耗盡;
③ ,將濾液轉入到密閉容器中,靜置、冷卻結晶;
④待結晶完畢后,濾出晶體,用少量冰水洗滌2~3次,再用濾紙將晶體吸干;
⑤將制得的FeSO4·7H2O晶體放在一個小廣口瓶中,密閉保存.
請回答下列問題:
(1)實驗步驟①的目的是___________________________________________。
(2)寫出實驗步驟②中的化學方程式__________________________________________。
(3)補全實驗步驟③的操作名稱_________________________。
(4)實驗步驟④中用少量冰水洗滌晶體,其目的是_______________________________。
(5)乙同學認為甲的實驗方案中存在明顯的不合理之處,你______(填“是”或“否”)同意乙的觀點
(6)丙同學經查閱資料后發現,硫酸亞鐵在不同溫度下結晶可分別得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O.硫酸亞鐵在不同溫度下的溶解度和該溫度下析出晶體的組成如下表所示(僅在56.7℃、64℃溫度下可同時析出兩種晶體).
硫酸亞鐵的溶解度和析出晶體的組成
請根據表中數據畫出硫酸亞鐵的溶解度曲線示意圖。__
(7)若需從硫酸亞鐵溶液中結晶出FeSO4·4H2O,應控制的結晶溫度(t)的范圍為________________。
(8)取已有部分氧化的綠礬固體(硫酸亞鐵的相對原子質量用M表示)wg,配制成100 mL用c mol/L KMnO4標準溶液滴定,終點時消耗標準液的體積為VmL,則:若在滴定終點讀取滴定管讀數時,俯視滴定管液面,使測定結果________(填“偏高”、“偏低”或“無影響”)
【答案】去除油污或利用碳酸鈉水解后顯堿性的性質除去表面油污 Fe+H2SO4(稀) ![]() FeSO4+H2↑ 趁熱過濾 洗去雜質,降低洗滌過程中FeSO4·7H2O的損耗 是
FeSO4+H2↑ 趁熱過濾 洗去雜質,降低洗滌過程中FeSO4·7H2O的損耗 是 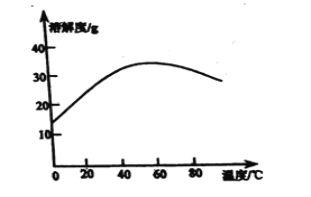 56.7℃<t<64℃ 偏低
56.7℃<t<64℃ 偏低
【解析】
(1)Na2CO3溶液顯堿性,鐵屑表面含有油脂,油脂在堿性條件下,水解成可溶水的物質,步驟①的目的是除去鐵屑表面的油污;
(2)發生化學方程式為Fe+H2SO4![]() FeSO4+H2↑;
FeSO4+H2↑;
(3)步驟③將濾液轉入到密閉容器,冷卻結晶,因此步驟③的操作名稱為趁熱過濾;
(4)一般溫度低,晶體的溶解度低,冰水洗滌的目的是洗去表面的雜質,減少FeSO4·7H2O的損耗;
(5)步驟②中鐵屑耗盡,鐵轉化成Fe2+,Fe2+容易被氧化成Fe3+,即同意乙同學的觀點;
(6)根據表格中的數據,得出: ;
;
(7)根據表格中的數據,得到FeSO4·4H2O,在56.7℃、64℃同時析出兩種晶體,因為溫度控制在高于56.7℃,低于64℃,范圍是56.7℃<t<64℃;
(8)根據得失電子數目,推出FeSO4·7H2O的質量分數為![]() ,根據滴定管從上到下刻度增大,俯視讀數,V偏小,即所測結果偏低。
,根據滴定管從上到下刻度增大,俯視讀數,V偏小,即所測結果偏低。


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:
【題目】已知X、Y、Z、M、R五種元素中,原子序數依次增大,其結構或性質信息如下表。請根據信息回答有關問題:
元素 | 結構或性質信息 |
X | 原子的L層上s電子數等于p電子數 |
Y | 原子核外的L層有3個未成對電子 |
Z | 在元素周期表的各元素中電負性僅小于氟 |
M | 單質常溫、常壓下是氣體,原子的M層上有1個未成對的p電子 |
R | 第四周期過渡元素,其價電子層各能級處于半充滿狀態 |
(1)元素M的原子核外有 ______ 種不同運動狀態的電子;
(2)五種元素中第一電離能最高的是_______寫元素符號;
(3)在Y形成的單質中,![]() 鍵與
鍵與![]() 鍵數目之比為______,在
鍵數目之比為______,在![]() 中Z原子的雜化方式為_____,其分子的空間構型為 ______;
中Z原子的雜化方式為_____,其分子的空間構型為 ______;
(4)R的一種配合物的化學式為![]() 。已知
。已知![]() 在水溶液中用過量硝酸銀溶液處理,產生
在水溶液中用過量硝酸銀溶液處理,產生![]() AgCl沉淀,此配合物最可能是 ______填序號。
AgCl沉淀,此配合物最可能是 ______填序號。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯用途廣泛,工業上可通過下列流程合成二甘醇及其衍生物。已知:R-OH + SOCl2 → R-Cl + SO2 ↑+ HCl↑ 請回答:

(1)寫出B的官能團的電子式________________________。
(2)寫出有關物質的結構簡式:A_________________D_________________。
(3)指出反應類型:②_________________。
(4)寫出下列化學方程式:反應①______________;反應②___________。
(5)①二甘醇又名(二)乙二醇醚,根據其結構判斷下列說法正確的是____(填序號)。
a. 難溶于水 b. 沸點較高 c. 不能燃燒
②E的同分異構體很多,寫出其中能夠發生銀鏡反應的兩種異構體的結構簡式_________________。
(6)請寫出由1-氯丙烷合成丙酮的合成路線圖并注明反應條件(無機試劑任選)________。合成路線流程圖示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() Br-CH2CH2-Br
Br-CH2CH2-Br
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將 0.10 mol·L-1 鹽酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 隨加入鹽酸體積變化曲線如圖所示。已知:pOH=-lg c(OH-),下列正確的是

A. M 點所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 點所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 點鹽酸與氨水恰好中和
D. M 點到Q點所示溶液中水的電離程度先變大后減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】熱激活電池可用作火箭、導彈的工作電源。一種熱激活電池的基本結構如圖所示,其中作為電解質的無水LiCl﹣KCl混合物受熱熔融后,電池即可瞬間輸出電能。該電池總反應為PbSO4+2LiCl+Ca═ CaCl2+Li2SO4+Pb。下列有關說法正確的是

A. 正極反應式:Ca+2Cl-﹣2e-= CaCl2
B. 放電過程中,Li+向負極移動
C. 常溫時,在正負極間接上電流表或檢流計,指針發生偏轉
D. 每轉移0.1 mol電子,理論上生成10.35g Pb
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫鹵酸的能量關系如圖所示下列說法正確的是

A. 已知HF氣體溶于水放熱,則HF的△H1<0
B. 相同條件下,HCl的△H2比HBr的小
C. 相同條件下,HCl的△H3+△H4比HI的大
D. 一定條件下,氣態原子生成1molH-X鍵放出akJ能量,則該條件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.有下列微粒:①11H、②21H、③31H、④16O2、⑤16O3。回答下列問題(填序號):
(1)以上5種微粒中共含有___種元素,__互為同素異形體;
(2)___互稱為同位素。
Ⅱ.根據下列提供的一組物質回答問題:
①HCl ②CaCl2 ③MgO ④Cl2 ⑤NaOH ⑥NH4Cl
(1)僅含共價鍵的是___;離子化合物有___;(用序號表示)
(2)既有離子鍵又有共價鍵的是___;含有非極性鍵的是__;(用序號表示)
(3)HCl的電子式:____;NaOH的電子式:____;MgO的電子式:____。
用電子式表示CaCl2的形成過程:____________
用電子式表示Cl2的形成過程:______________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com