
| 溫度/℃ | 25 | T1 | T2 |
| 水的離子積常數 | 1×10-14 | a | 1×10-12 |
分析 (1)水的電離過程為吸熱反應,溫度升高,水的電離程度增大,水的離子積增大;
(2)溶液中鈉離子濃度是1×10-3 mol/L,如果稀釋10倍,則鈉離子濃度是1×10-4 mol/L;硫酸鈉溶液是顯中性的,稀釋后溶液中氫離子濃度仍然為10-7mol/L;
(3)混合液的pH=2,酸過量,根據c(H+)=$\frac{n({H}^{+})-n(O{H}^{-})}{{V}_{總}}$計算;根據反應后溶液的組成分析各種離子的濃度大小;
(4)硫酸中氫氧根離子是水電離的,硫酸鋁中的氫離子是水電離的,根據溶液的pH相同可知:10a-14=10-b.
解答 解:(1)由于水的電離電離過程為吸熱反應,溫度越高,水的電離程度越大,水的離子積越大,所以若25℃<t1<t2,則KW>1×10-14,
故答案為:>;水的電離吸熱,溫度升高,水的電離程度增大,所以水的離子積增大;
(2)25℃時,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,則溶液中鈉離子濃度是1×10-3 mol/L,如果稀釋10倍,則鈉離子濃度是1×10-4 mol/L;但硫酸鈉溶液是顯中性的,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案為:1000:1;
(3)混合液的pH=2,酸過量,c(H+)=c(H+)=$\frac{0.1mol/L×{V}_{2}L-0.1mol/L×{V}_{2}L}{{V}_{1}+{V}_{2}}$=0.01,
解之得:V1:V2=9:11;
c(Na+)=0.1×9/(9+11)=0.045mol/L、c(SO42-)=0.05×11/20=0.0275mol/L、c(H+)=0.01mol/L,
硫酸過量溶液顯酸性,c 則(H+)>c (OH-),
故溶液中各種離子的濃度由大到小的排列順序是:c (Na+)>c (SO42-)>c (H+)>c (OH-),
故答案為:9:11;c(Na+)>c(SO42-)>c(H+)>c(OH-);
(4)常溫下,設某pH值的硫酸中水電離出的c(H+)=1.0×10-amol/L,溶液中的氫氧根離子是水電離的,則硫酸中氫離子濃度為c(H+)=10a-14mol/L;
設相同pH值的硫酸鋁中水電離出的c(H+)=1.0×10-b mol/L,硫酸鋁中的氫離子是水電離的,由pH相同可知:10a-14=10-b,則:a+b=14,
故答案為:a+b=14.
點評 本題考查了溶液中離子濃度大小比較以及溶液pH的計算,題目難度中等,該題是高考中的常見題型,屬于中等難度的試題;該題的關鍵是明確溶液中幾個重要守恒關系,即:電荷守恒、物料守恒和質子守恒,試題培養了學生的分析、理解能力及靈活應用基礎知識的能力.


 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源: 題型:解答題
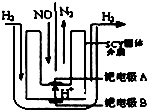 汽車尾氣中NOx的消除及無害化處理引起社會廣泛關注.
汽車尾氣中NOx的消除及無害化處理引起社會廣泛關注.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 (1)將一定量固體A置于一個容器體積不變的密閉容器中發生如下反應:
(1)將一定量固體A置于一個容器體積不變的密閉容器中發生如下反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
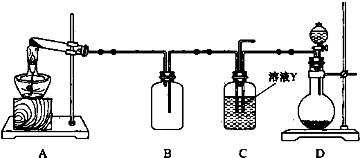
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl固體中含有共價鍵 | |
| B. | CO2分子中含有離子鍵 | |
| C. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳的三種核素 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅酸鈉溶液中通入SO2產生白色沉淀,判斷Si和S的非金屬性強弱 | |
| B. | 比較H2O和H2S還原性強弱,判斷O和S的非金屬性強弱 | |
| C. | 鈉和鎂分別與冷水反應,判斷鈉和鎂金屬性強弱 | |
| D. | 鐵片投入硫酸銅溶液中,鐵片上有紫紅色物質生成,判斷Fe和Cu的金屬性強弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗 序號 | 鐵的 質量g | 鐵的 形態 | C(H2SO4) Mol/L | V(H2SO4) m L | 溶液溫度 | 金屬消失的時間s | |
| 反應前 | 反應后 | ||||||
| 1 | 0.10 | 鐵片 | 0.7 | 50 | 20 | 36 | 250 |
| 2 | 0.10 | 鐵片 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 鐵粉 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 鐵片 | 1.0 | 50 | 20 | 35 | 125 |
| 5 | 0.10 | 鐵片 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在某些分子中,化學鍵可能只有π鍵而沒有σ鍵 | |
| B. | 當原子形成分子時,首先形成σ鍵,可能形成π鍵,配位鍵都是σ鍵 | |
| C. | σ鍵的特征是軸對稱,π鍵的特征是鏡面對稱 | |
| D. | 含有π鍵的分子在反應時,π鍵是化學反應的積極參與者 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com