
【題目】一定溫度下在密閉容器內進行著某一反應,X氣體、Y氣體的物質的量隨反應時間變化的曲線如下圖。下列敘述中正確的是

A. 反應的化學方程式為5YX
B. t1時,Y的濃度是X濃度的1.5倍
C. t2時,正、逆反應速率相等
D. t3時,逆反應速率大于正反應速率
科目:高中化學 來源: 題型:
【題目】某興趣小組同學利用氧化還原反應:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O設計如下原電池,鹽橋中裝有用飽和Na2SO4溶液浸泡過的瓊脂。下列說法正確的是

A.b電極上發生的反應:Fe2+ - e- ═ Fe3+
B.a電極上發生氧化反應:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外電路電子的流向是從a到b
D.電池工作時,鹽橋中的SO42-移向甲燒杯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了探究FeSO4和Cu(NO3)2的混合物中各組分的含量,現設計如下流程:
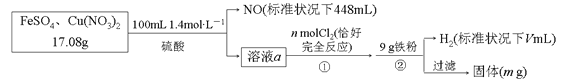
下列敘述中不正確的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的質量分數約為89%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)從古至今,鐵及其化合物在人類生產生活中的作用發生了巨大改變。
(1)古代中國四大發明之一的指南針是由天然磁石制成的,其主要成分是 (填字母序號)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化學成分為:SiO2約45%,Fe2O3約40%,Al2O3約10%,MgO約5%。用該廢渣制取藥用輔料——紅氧化鐵的工藝流程如下(部分操作和條件略):

回答下列問題:
①在步驟i中產生的有毒氣體可能有_____________。
②在步驟iii操作中,要除去的離子之一為Al3+。若常溫時Ksp[Al(OH)3]=1.0×1032,此時理論上將Al3+沉淀完全,則溶液的pH為______。
③步驟iv中,生成FeCO3的離子方程式是_______________________________。
(3)氯化鐵溶液稱為化學試劑中的“多面手”。向氯化銅和氯化鐵的混合溶液中加入氧化銅粉末會產生沉淀,寫出該沉淀的化學式 。請用平衡移動的原理,結合必要的離子方程式,對此現象作出解釋 。
(4)①古老而神奇的藍色染料普魯士藍的合成方法如下:
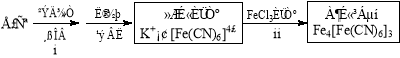
復分解反應ii的離子方程式是 。
②如今基于普魯士藍合成原理可檢測食品中是否含CN,方案如下:
![]()
若試紙變藍則證明食品中含有CN,請解釋檢測時試紙中FeSO4的作用 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化尿素是一種新型漂泊、消毒劑,廣泛應用與農業、醫藥、日用化工等領域。用低濃度的雙氧水和飽和尿素溶液在一定條件下可以合成過氧化尿素。反應的方程式為:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。過氧化尿素的部分性質如下:
CO(NH2)2·H2O2。過氧化尿素的部分性質如下:
分子式 | 外觀 | 熱分解溫度 | 熔點 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶體 | 45℃ | 75~85℃ | 易溶于水、有機溶劑 |
合成過氧化尿素的流程及反應裝置圖如圖:

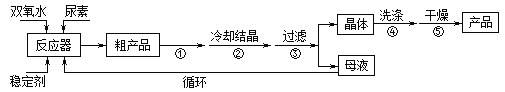
請回答下列問題:
(1)儀器X的名稱是__________;冷凝管中冷卻水從____(填“a”或“b”)口出來;
(2)該反應的溫度控制30℃而不能過高的原因是_______________________。
(3)步驟①宜采用的操作是_____________。
A.加熱蒸發 B.常壓蒸發 C.減壓蒸發
(4)若實驗室制得少量該晶體,過濾后需要用冷水洗滌,具體的洗滌操作是_________________。
(5)準確稱取1.000g產品于250mL錐形瓶中,加適量蒸餾水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4標準溶液滴定至終點時消耗18.00mL(尿素與KMnO4溶液不反應),則產品中CO(NH2)2·H2O2的質量分數為_____________;若滴定后俯視讀數,則測得的過氧化尿素含量________(填“偏高”、“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬鈉的性質和用途的描述中體現了它的強還原性的是
A. 鈉可以用刀切割 B. 鈉可以保存在煤油中
C. 鈉可以用于冶煉金屬鈦 D. 鉀鈉合金用于核反應堆的導熱劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分別向等體積1mol/L鹽酸和1mol/L醋酸溶液中加入等量的鎂條,反應時間與溶液pH變化關系如右圖。下列說法中不正確的是( )

A. Y代表鹽酸與鎂條的反應
B. a點時反應Y消耗鎂條的量少
C. b點表示此時兩溶液pH相等
D. c點表示此時反應結束
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下將3 mol CO2和2 mol H2混合于2 L的密閉容器中,發生如下反應:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)已知在700 ℃時,該反應的平衡常數K1=0.6,則該溫度下反應![]() CO2(g)+
CO2(g)+![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+![]() H2O(g)的平衡常數K3=__________。
H2O(g)的平衡常數K3=__________。
(2)已知在1 000 ℃時,該反應的平衡常數K4為1.0,則該反應為__________反應(填“吸熱”或“放熱”)。
(3)能判斷該反應達到化學平衡狀態的依據是________。(填編號)
A.容器中壓強不變 B.c(CO2)=c(CO)
C.生成a mol CO2的同時消耗a mol H2 D.混合氣體的平均相對分子質量不變
(4)在1 000 ℃下,某時刻CO2的物質的量為2.0 mol,則此時v正______v逆(填“>”、“=”或“<”)。該溫度下反應達到平衡時,CO2的轉化率為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com