
【題目】T℃時,在容積為0.5L的密閉容器中發生如下反應。mA(g)+nB(g)![]() pC(g)+qD(s) △H<0(m、n、p、q為最簡整數比)。 A、B、C、D的物質的量變化如圖所示。
pC(g)+qD(s) △H<0(m、n、p、q為最簡整數比)。 A、B、C、D的物質的量變化如圖所示。

(1)前3 min,v(C)=_____________。
(2)當下列物理量不再發生變化時,表明該反應已達到平衡狀態的是________(填選項字母)。
A.混合氣體的壓強 B.混合氣體的密度
C.混合氣體的平均相對分子質暈
D.B的物質的量 E.混合氣體的總物質的量
(3)T℃時,該反應的平衡常數K=____________。(小數點后保留2位)
(4)反應達到平衡后,下列措施對A的轉化率無影響的是___________(填選項字母)。
A.保持體積不變,再通入2molA和1molB
B.移走一部分D C.把容器的體積縮小一倍 D.升高溫度
(5)T℃時,容積為1 L的密閉容器中,起始時充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 molD, 此時v(正)________ (逆)(填“>”、“<”或“=”),判斷的依據是____________________________。
【答案】 0.4 mol·L-1·min-1 BCD 1.69 BC = ![]() =
=![]() =1.69=K(或濃度商與平衡常數相等或Qc=K,其他合理答案也給分)
=1.69=K(或濃度商與平衡常數相等或Qc=K,其他合理答案也給分)
【解析】(1)前3 min,v(C)=△c/△t=0.6mol/(0.5L×3min)=0.4 molL-1min-1;(2)根據圖中數據知道,A、B、C、D四種物質的物質的量的變化量之比是0.4:0.2:0.6:0.2=2:1:3:1,等于方程式的系數之比,方程式表示為:2A(g)+B(g)3C(g)+D(s),A.反應前后氣體的體積不變,所以混合氣體的壓強不變化,不一定平衡,A錯誤;B.混合氣體的密度等于質量和體積的比值,質量變化,體積不變,所以當密度不變了,達到了平衡,B正確;C.混合氣體的平均相對分子質量是質量和物質的量的比值,質量變化,物質的量不變,所以當混合氣體的平均相對分子質量不變了,達到了平衡,C正確;D.B的物質的量不變化,是平衡狀態的特征,達到了平衡,D正確;E.混合氣體的總的物質的量始終是不變化的,E錯誤,答案選BCD;(3)當達到平衡時,A、B、C的濃度分別是0.8mol/L、1.6mol/L、1.2mol/L,平衡常數K=c3(C)/c2(A)(B)=![]() =1.69;(4)反應2A(g)+B(g)3C(g)+D(s),達到平衡后,A.保持體積不變,通入2mol A和1mol B,會使得A的轉化率減小,A錯誤;B.D是固體,移走一部分D,平衡不移動,A的轉化率不變,B正確;C.把容器的體積縮小一倍,即加壓,平衡不移動,A的轉化率不變,C正確;D.升高溫度,平衡逆向移動,A的轉化率減小,D錯誤,答案為選BC;(5)T℃時,容積為1 L的密閉容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此時Qc=c3(C)/c2(A)(B)=
=1.69;(4)反應2A(g)+B(g)3C(g)+D(s),達到平衡后,A.保持體積不變,通入2mol A和1mol B,會使得A的轉化率減小,A錯誤;B.D是固體,移走一部分D,平衡不移動,A的轉化率不變,B正確;C.把容器的體積縮小一倍,即加壓,平衡不移動,A的轉化率不變,C正確;D.升高溫度,平衡逆向移動,A的轉化率減小,D錯誤,答案為選BC;(5)T℃時,容積為1 L的密閉容器中,起始充入0.2mol A、0.4 mol B、0.3 mol C、0.5mol D,此時Qc=c3(C)/c2(A)(B)=![]() =1.69=K,仍然是平衡狀態,故正逆反應速率相等。
=1.69=K,仍然是平衡狀態,故正逆反應速率相等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】化學與生產、生活、社會密切相關。下列有關說法中正確的是
A. 草木灰溶液呈堿性,不能與銨態氮肥混合施用
B. 漂白粉中Ca(ClO)2具有強氧化性,能用來凈化水
C. 碳納米管是新型有機合成纖維,可用作儲氫材料
D. 為防止食品腐敗可在其包裝袋里放置硅膠顆粒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知一定溫度下,下列反應的平衡常數:H2(g)+S(s)![]() H2S(g) K1,
H2S(g) K1,
S(s)+02(g)![]() SO2(g) K2。則相同溫度下反應H2(g)+SO2(g)
SO2(g) K2。則相同溫度下反應H2(g)+SO2(g)![]() O2(g)+H2S(g)的
O2(g)+H2S(g)的
平衡常數為( )
A. K1+K2 B. K1-K2 C. K1·K2 D. K1/K2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎮痙藥物C、化合物N以及高分子樹脂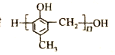 的合成路線如下:
的合成路線如下:

(1)A的化學名稱為_____,A在催化劑作用下可與H2反應生成B,B的式量為108,B的結構簡式為_____。
(2)C中官能團的名稱為_____,C在堿性條件下水解的化學反應方程式為_____。
(3)A與銀氨溶液反應的化學方程式為_________。
(4)F與甲醛合成高分子樹脂的反應類型為_________,N的結構簡式為________。
(5)扁桃酸的一種同分異構體滿足下列條件:
①遇FeCl3溶液不發生顯色反應
②能發生銀鏡反應,在酸性條件下水解產物之一能與FeCl3溶液發生顯色反應
③分子中有5種不同化學環境的氫,核磁共振氫譜峰面積之比為:1:2:2:1.
寫出該同分異構體的結構簡式________。
(6)寫出用乙醇為原料制備化合物CH3COCl的合成路線_________。
合成路線流程圖示例如下:
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鹵族元素在生活中有廣泛應用,根據所需知識回答下列問題。
(1)氟元素基態原子的價電子排布圖:_________,鹵族元素位于元素周期表______區。
(2)在一定濃度的氫氟酸溶液中,部分溶質以二分子締合(HF)2形式存在,使HF分子締合的作用力是_______________。
(3)BF3常溫下是氣體,有強烈的接受弧電子對的傾向。BF3分子的立體構型為______,固態時的晶體類型是_______,BF3與NH3相遇立即生成白色固體,寫出該白色固體物質的結構式并標注出其中的配位鍵_____。
(4)根據下表提供的數據判斷,熔點最高、硬度最大的是_______(填化學式)。
離子晶體 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶體中陰離子為V型,ClO2-中氯原子的弧電子對數是______,ClO2-中氯原子的雜化軌道類型為_____,HClO4比HClO2酸性強的原因是_______。
(6)CaF2晶胞如下圖所示。已知:NA為阿伏伽德羅常數,棱上相鄰的兩個Ca2+的核間距為acm,則CaF2的密度可表示為_____g·cm-3。
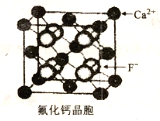
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用98%(質量分數)的濃硫酸來配制一定體積的1.0mol·L-1的稀硫酸時,下列儀器不需要用到的是
A. 玻璃棒 B. 膠頭滴管 C. 托盤天平 D. 容量瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列填空:
(1)寫出氯化鈉的電子式_______________,氮氣的結構式______________;
(2)用離子方程式表示氨水溶液顯堿性的原因_________________;
用離子方程式表示碳酸鈉溶液顯堿性的原因_____________________;
(3)某碳氫化合物的相對分子質量為72,且一個分子結構中有3個甲基,則該有機物的結構簡式為____________,該有機物的系統命名是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黃色)+2H+。用K2Cr2O7溶液進行下列實驗:
2CrO42-(黃色)+2H+。用K2Cr2O7溶液進行下列實驗:
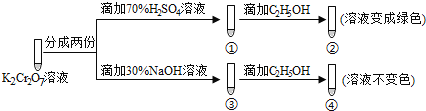
結合實驗,下列說法不正確的是
A.①中溶液橙色加深,③中溶液變黃
B.②中Cr2O72-被C2H5OH還原
C.對比②和④可知K2Cr2O7酸性溶液氧化性強
D.若向④中加入70%H2SO4溶液至過量,溶液變為橙色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com