
【題目】(1)CO還原脫硝技術可有效降低煙氣中的NOx的排放量。回答下列問題:
CO還原NO的脫硝反應:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
已知:CO(g)+NO2(g)CO2(g)+NO(g) △H1=—226kJmol—1
N2(g)+2O2(g)2NO2(g) △H2=+68kJmol—1
N2(g)+O2(g)2NO(g) △H3=+183kJmol—1
脫硝反應△H=______,該反應向正反應方向自發進行的傾向很大,其原因是_______,有利于提高NO平衡轉化率的條件是(寫出兩條)________、___________。
(2)直接供氨式燃料電池是以NaOH溶液為電解質的.電池反應為:4NH3+3O2=2N2+6H2O,則負極電極反應式為_________。
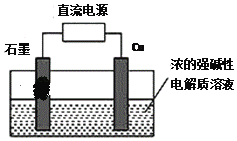
(3)用甲醇燃料電池作為直流電源,設計如圖裝置制取Cu2O,電解總反應為:2Cu+H2O=Cu2O+H2↑。寫出陽極的電極反應式_______。
【答案】-750kJ/mol 該反應為放熱量大的反應 降溫 升壓或增大CO和NO的投料比等 NH3+6OH--6e-=N2+6H2O 2Cu+2OH--2e-=Cu2O+H2O
【解析】
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,蓋斯定律計算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H;該反應向正反應方向自發進行的傾向很大,說明反應放熱多,根據外界條件對化學平衡的影響分析有利于提高NO 平衡轉化率的方法;
(2)根據原電池工作原理及電極反應寫出該燃料電池的負極反應式;
(3)由總的反應式2Cu+H2O=Cu2O+H2↑可知:銅的化合價升高,被氧化,是電解池的陽極,銅最后生成氧化亞銅,由此寫出陽極電極反應式。
(1)已知:①CO(g)+NO2(g)CO2(g)+NO(g)△H1=-226kJmol-1,②N2(g)+2O2(g)2NO2(g)△H2=+68kJmol-1,③N2(g)+O2(g)2NO(g)△H3=+183kJmol-1,蓋斯定律計算①×2+②-③×2得到2CO(g)+2NO(g)2CO2(g)+N2(g)△H=-750kJ/mol;該反應向正反應方向自發進行的傾向很大,其原因是該反應為放熱量大的反應,反應為氣體體積減小的放熱反應,有利于提高NO 平衡轉化率的條件是:降溫、升壓、增大CO和NO的投料比等;
(2)原電池負極失去電子發生氧化反應,所以該燃料電池中負極氨氣失去電子生成氮氣,電極反應式為2NH3+6OH--6e-=N2+6H2O;
(3)由總的反應式2Cu+H2O=Cu2O+H2↑可知:銅的化合價升高,被氧化,是電解池的陽極,電極反應式為:2Cu+2OH--2e-=Cu2O+H2O。


科目:高中化學 來源: 題型:
【題目】一種微生物燃料電池的結構示意圖如下所示,關于該電池的敘述正確的是( )
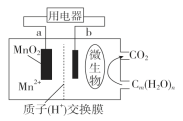
A. 電池工作時,電子由a流向b
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 正極反應式為:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前比較熱門的Al-H2O2電池,其電池總反應為2Al+![]() =
=![]() +OH-+H2O。現以AlH2O2電池電解尿素[CO(NH2)2]的堿性溶液制備氫氣(裝置2中隔膜僅阻止氣體通過,b、c、d均為惰性電極)。下列說法正確的是
+OH-+H2O。現以AlH2O2電池電解尿素[CO(NH2)2]的堿性溶液制備氫氣(裝置2中隔膜僅阻止氣體通過,b、c、d均為惰性電極)。下列說法正確的是
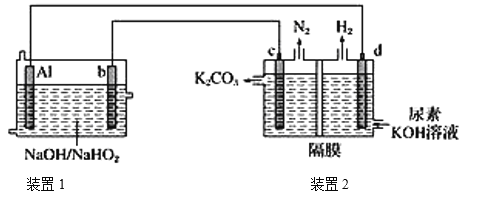
A.裝置1中Na+移向電極b,裝置2中的隔膜可以換成質子交換膜
B.電極c的電極反應式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.電解時,電流的流動路徑:Al極→導線→d極→電解質溶液→c極→導線→b極
D.通電5 min后,若Al電極的質量減輕5.4g,則產生H2的體積為4.48L(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解NO制備 NH4NO3的工作原理如圖所示,X、Y皆Pt電極,為使電解產物全部轉化為NH4NO3,需補充物質A。下列說法正確的是( )
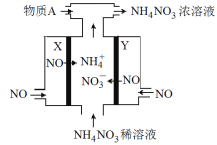
A. 物質A為NH3
B. X電極為電解池陽極
C. Y電極上發生了還原反應
D. Y電極反應式為:NO-3e-+4OH-==NO3-+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用鄰苯二甲酸氫鉀,(分子式為![]() 相對分子質量為204)測定NaOH溶液的濃度,若NaOH溶液的濃度在0.1mol/L左右,滴定終點時溶液的pH約為9.1。
相對分子質量為204)測定NaOH溶液的濃度,若NaOH溶液的濃度在0.1mol/L左右,滴定終點時溶液的pH約為9.1。
(1)寫出鄰苯二甲酸氫鉀與NaOH反應的化學方程式:________。
(2)將用分析天平精確稱量的鄰苯二甲酸氫鉀放于錐形瓶中,加適量的水溶解,溶液無色,再加入指示劑_____(從甲基橙、酚酞、石蕊中選擇),用NaOH溶液滴定到終點時,現象是________。
(3)該實驗要用到的主要玻璃儀器_______、______。
(4)該學生進行三次實驗,所取固體的質量均相同,填寫下表:
實驗 編號 | 鄰苯二甲酸氫鉀的質量(g) | 待測NaOH溶液的體積(mL) |
1 | 0.4488 | 22.24 |
2 | 20.04 | |
3 | 19.96 |
滴定中誤差較大的是第_____次實驗,造成這種誤差的可能原因是_____
a.滴定時有NaOH溶液滴到錐形瓶外面;
b.未用NaOH溶液潤洗滴定管;
c.NaOH溶液在“0”刻度線以上,未予調整就開始滴定;
d.觀察記錄滴定管內液面刻度時滴定前仰視,滴定后俯視;
e.酚酞指示劑由無色變為紅色時立即停止滴定。
(5)NaOH溶液的物質的量濃度為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中學常見反應的化學方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反應條件略去),下列問題所涉及反應是上述兩個方程式之一。請回答:
(1)常溫下,若A為黃綠色氣體,B為非金屬氧化物,A、B均能使品紅溶液褪色,A+B+H2O→X+Y,則該反應的化學方程式_________________
(2)若A為金屬單質,其與B的濃溶液常溫鈍化而加熱則可以反應,而且所得的三種產物在常溫下又可以發生反應,則作氧化劑的B與表現酸性的B的物質的量之比是_____。
(3)若A為常見的非金屬單質,B的溶液為某濃酸,其中A、B的物質的量之比為1∶4,而且該反應能產生一種造成光化學煙霧的氣體,則該反應化學方程式為_______________
(4)若A、B均為化合物,Y為白色沉淀(不含金屬元素),B為引起溫室效應的主要氣體,寫出B(過量)與A反應生成Y的離子方程式________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)關系如圖所示,下列說法錯誤的是( )
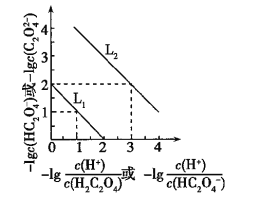
A. Ka1(H2C2O4)=1×10-2
B. 滴定過程中,當pH=5時,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等體積等濃度的NaOH溶液,完全反應后顯酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀釋,C(HC2O4-)/C(H2C2O4)比值將增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中進行反應:2SO2+O2![]() 2SO3(g),已知反應過程中某一時刻SO2、O2和SO3濃度分別為0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。當反應達到平衡時,可能存在的數據是
2SO3(g),已知反應過程中某一時刻SO2、O2和SO3濃度分別為0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。當反應達到平衡時,可能存在的數據是
A.SO2為0.4 mol·L-1、O2為0.2 mol·L-1B.SO2為0.3 mol·L-1
C.SO3為0.4 mol·L-1D.SO2、SO3均為0.1 mol·L-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com