
【題目】Ni(CO)4可用于有機合成,也常用作催化劑。一定條件下,恒容密閉容器中發生反應Ni(s)+4CO(g)![]() Ni(CO)4(g),該反應的平衡常數與溫度的關系如下表所示:
Ni(CO)4(g),該反應的平衡常數與溫度的關系如下表所示:
溫度/℃ | 25 | 80 | 230 |
平衡常數 | 5×104 | 2 | 1.9×10-5 |
下列說法正確的是
A.25℃達到平衡時,向容器中繼續充入CO(g),CO的轉化率減小
B.溫度越低,越有利于Ni(CO)4的生產
C.80℃時,測得某時刻Ni(CO)4、CO的濃度均為0.5 mol·L-1,則此時v正<v逆
D.平衡后,向密閉容器中加入少量鎳粉,平衡正向移動,達到新平衡時CO的濃度比原平衡小
【答案】C
【解析】
A.向容器中繼續通入CO(g),相當于增大壓強,化學平衡正向進行,CO轉化率增大,A錯誤;
B.由圖表數據可知,溫度升高,化學平衡常數減小,說明該反應的正反應是放熱反應,降低溫度,化學平衡正向進行,但反應速率小,生產效益低,不利于Ni(CO)4的生產,B錯誤;
C.依據濃度商計算和平衡常數比較分析判斷反應進行方向,在80℃時,測得某時刻,Ni(CO)4、CO濃度均為0.5 mol/L,Qc=![]() =8>K=2,化學反應逆向進行,因此此時v正<v逆,C正確;
=8>K=2,化學反應逆向進行,因此此時v正<v逆,C正確;
D.固體物質濃度不變,因此平衡后,向密閉容器中加入少量鎳粉,對化學平衡無影響,平衡不移動,CO的濃度不變,D錯誤;
故合理選項是C。


科目:高中化學 來源: 題型:
【題目】請按要求填空:
(1)寫出![]() 中含氧官能團的名稱_______________;
中含氧官能團的名稱_______________;
(2)![]() 屬于__________類化合物;
屬于__________類化合物;
(3)CH2=CH—CH3在催化劑加熱條件下生成聚合物的反應方程式為________;
(4)寫出實驗室制乙炔的化學反應方程式_________________;
(5)①稱取3.4g某有機化合物A,完全燃燒后生成1.8g H2O和8.8g CO2,已知該有機物的蒸氣對氫氣的相對密度為68,則該有機物的分子式為_________________;
②該有機物A的核磁共振氫譜和紅外光譜如下:

試推測有機物A的結構簡式為_________________________;
③與A屬于同類有機物的同分異構體包括A共有_________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,pH=2的HA和HB各1 mL分別加水稀釋,pH隨溶液體積變化如圖所示。下列敘述正確的是

A. Kw的數值:a點大于c點
B. 溶液中的總酸量:a點大于b點
C. HB的電離程度:b點大于c點
D. 將a點與b點兩溶液同時升高溫度,則![]() 減小
減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中微粒的物質的量濃度關系不正確的是![]()
A.若將適量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,則溶液中
溶液中至溶液恰好呈中性,則溶液中![]() 不考慮溶液體積變化
不考慮溶液體積變化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水電離出的![]() ,若
,若![]() 時,則該溶液pH一定為
時,則該溶液pH一定為![]()
C.常溫下將相同體積的![]() 硫酸和
硫酸和![]() 一元堿BOH溶液混合,所得溶液可能為中性也可能為堿性
一元堿BOH溶液混合,所得溶液可能為中性也可能為堿性
D.等體積等物質的量濃度的NaClO溶液與NaCl溶液中離子總數大小:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】加熱N2O5,依次發生的分解反應:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在體積為2L密閉容器中充入8molN2O5,加熱到t℃,達到平衡狀態。此時O2為9mol, N2O3為3.4mol。則t℃時反應①的平衡常數為
N2O(g)+O2(g);在體積為2L密閉容器中充入8molN2O5,加熱到t℃,達到平衡狀態。此時O2為9mol, N2O3為3.4mol。則t℃時反應①的平衡常數為
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.300℃時將2molA和2molB兩種氣體混合于2L密閉容器中,發生如下反應:3A(g)+B(g)2C(g)+2D(g) △H,2min末達到平衡,生成0.8moLD。
(1)300℃時,該反應的平衡常數表達式為K=________,已知K300℃<K350℃,則△H________(填“>”或“<” 0).
(2)在2min末時,B的平衡濃度為________,D的平均反應速率為________。
(3)若溫度不變,縮小容器容積,則A的轉化率________![]() 填“增大”“減小”或“不變”
填“增大”“減小”或“不變”![]() 。
。
II.在一定條件下,可逆反應:mA+nBpC達到平衡,若:
(1)A、B、C都是氣體,減小壓強,平衡向正反應方向移動,則,m+n________(填“>”“<”或“![]() ” p)。
” p)。
(2)A、C是氣體,而且m+n=p,增大壓強可使平衡發生移動,則平衡移動的方向是________。
(3)加熱后,可使C的質量增加,則正反應是________(填“放熱”或“吸熱”)反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯(ClO2)是一種黃綠色易溶于水的氣體,常用作飲用水消毒。實驗室通過如下過程制備二氧化氯。下列說法正確的是

A. 電解時發生反應的離子方程式為NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B. 溶液X中大量存在的陰離子有Cl-、OH-
C. 可用飽和食鹽水除去ClO2中的NH3
D. 常用作凈水劑的明礬可除去飲用水中殘留的NaClO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈣(CaO2)是一種白色晶體,能潮解,難溶于水,可與水緩慢反應,不溶于乙醇,易與酸反應,常用作殺菌劑、防腐劑等。根據題意,回答相關問題。
I.CaO2晶體的制備:CaO2晶體通常可利用CaCl2在堿性條件下與H2O2反應制得。某化學興趣小組在實驗室制備CaO2的實驗方案和裝置示意圖如下:
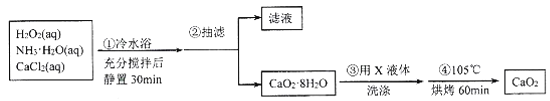

(1)三頸燒瓶中發生的主要反應的化學方程式為___________。
(2)冷水浴的目的是__;步驟③中洗滌CaO2·8H2O的實驗操作方法是__
Ⅱ.CaO2含量的測定:測定CaO2樣品純度的方法是:稱取0.200g樣品于錐形瓶中,加入50mL水和15mL2mol·L-lHCl,振蕩使樣品溶解生成過氧化氫,再加入幾滴MnCl2稀溶液,立即用0.0200mol·L-lKMnO4標準溶液滴定到終點,消耗25.00mL標準液。
(3)上述過程中使用稀鹽酸而不使用稀硫酸溶解樣品的原因是______;滴定前加入MnCl2稀溶液的作用可能是______。
(4)滴定過程中的離子方程式為____,樣品中CaO2的質量分數為____。
(5)實驗I制得的晶體樣品中CaO2含量偏低的可能原因是:_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷化氫(PH3)是一種劇毒氣體,是常用的高效熏蒸殺蟲劑,也是一種電子工業原料.
(1)在密閉糧倉放置的磷化鋁(AIP)片劑,遇水蒸氣放出PH3氣體,化學方程式為 ______
(2)利用反應PH3+3HgCl2=P(HgCl)3↓+3HCl,通過測定溶液 ______ 變化,可準確測定空氣中微量的PH3;其中HgCl2溶于水,所得溶液幾乎不導電,則HgCl2屬于 ______ (填“共價”或“離子”)化合物.
(3)工業制備PH3的流程如圖1所示:

①亞磷酸屬于 ______ 元酸;
②當反應I生成的n(NaH2PO2):n(Na2HPO3)=3:1時,參加反應的n(P4):n(NaOH)= ______ .
(4)用漂白粉可將PH3氧化為H3PO4,化學方程式為 ______ ;含有水蒸氣時可加快PH3的氧化過程,用離子方程式表示原因: ______ .
(5)從(4)中的反應產物中回收磷酸氫鈣(CaHPO4)的方法如圖2:

①試劑X為 ______ (填化學式);
②已知25℃時,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4懸濁液pH ______ 7(填“>”、“=”或“<”),通過計算說明理由 ______ .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com