
| A. | 鐵表面鍍銅時,鐵與電源的正極相連,銅與電源的負極相連 | |
| B. | 向氨水中不斷通入CO2,隨著CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不斷增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常溫下不能自發進行,說明該反應的△H>0 | |
| D. | 合成氨時,其他條件不變升高溫度,反應速率v(H2)和氫氣的平衡轉化率均增大 |
分析 A.電鍍池中,作陽極的是鍍層金屬,做陰極的是待鍍金屬;
B.向氨水中不斷通入CO2,一水合氨濃度減小,銨根離子濃度增大,結合電離常數分析;
C.根據反應自發進行的判斷依據△H-T△S<0分析解答;
D.合成氨反應為放熱反應.
解答 解:A.在鐵件的表面鍍銅的電鍍池中,作陽極的是鍍層金屬銅,與電源的正極相連,陽極上金屬銅失電子發生氧化反應,陰極上銅離子得電子生成銅單質,鐵與電源的負極相連做陰極,故A錯誤;
B.向氨水中不斷通入CO2,一水合氨濃度減小,銨根離子濃度增大,由于$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$是常數,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不斷減小,故B錯誤;
C.3C(s)+CaO(s)=CaC2(s)+CO(g)在常溫下不能自發進行,已知△S>0,由△H-T△S<0可知,說明該反應的△H>0,故C正確;
D.合成氨反應為放熱反應,升高溫度反應速率加快,平衡逆向移動,所以氫氣的轉化率減小,故D錯誤;
故選C.
點評 本題考查了電鍍原理的應用、弱電解質的電離、反應自發進行的判斷以及化學平衡的影響因素等知識點,題目難度中等,側重于考查學生對基礎知識的應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年浙江省高一上10月月考化學試卷(解析版) 題型:選擇題
下列關于物質的類別的說法不正確的是
A.能在水溶液中或熔融狀態下導電的化合物就是電解質
B.膠體是一種能產生丁達爾效應的分散系
C.純堿不屬于堿,干冰屬于酸性氧化物
D.Na2O和Na2O2都能與水反應生成對應的堿,它們都是堿性氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
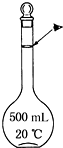 實驗室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步驟:
實驗室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步驟:查看答案和解析>>
科目:高中化學 來源:2016-2017學年天津市高一上9月調研化學試卷(解析版) 題型:選擇題
將下列溶液與1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液c(Cl-)最大的是
A.50 mL 1 mol·L-1 NaCl溶液 B.20 mL 2 mol·L-1 A lCl3溶液
lCl3溶液
C.30 mL 1 mol·L-1 MgCl2溶液 D.100 mL 3 mol·L-1 KClO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
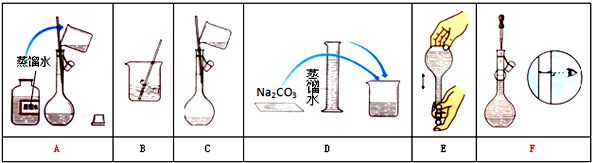
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
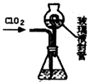 二氧化氯(C1O2)是目前國際上公認的第四代高效、無毒的消毒劑,是一種黃綠色的氣體,易溶于水.實驗室可用Fa-14Cl、鹽酸、NaCl02(亞氯酸鈉)為原料制備C1O2的流程如下:
二氧化氯(C1O2)是目前國際上公認的第四代高效、無毒的消毒劑,是一種黃綠色的氣體,易溶于水.實驗室可用Fa-14Cl、鹽酸、NaCl02(亞氯酸鈉)為原料制備C1O2的流程如下: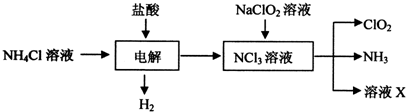
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚2-甲基-1-丙烯可以通過加聚反應制得 | |
| B. | 聚2-甲基-1-丙烯的分子式為 (C4H8)n | |
| C. | 聚2-甲基-1-丙烯完全燃燒生成CO2和H2O的物質的量相等 | |
| D. | 聚2-甲基-1-丙烯能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com