
【題目】為了研究外界條件對過氧化氫分解速率的影響,某同學做了以下實驗,請回答下列問題。
編號 | 操作 | 實驗現象 |
① | 分別在試管A、B中加入5mL 5% H2O2溶液,各滴入2滴等濃度 FeCl3溶液.待試管中均有適量氣泡出現時,將試管A放入盛有5℃左右冷水的燒杯中浸泡;將試管B放入盛有40℃左右熱水的燒杯中浸泡 | 試管A中不再產生氣泡;試管B中產生的氣泡量增大 |
② | 另取兩支試管分別加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 試管A、B中均未明顯見到有氣泡產生 |
(1)過氧化氫分解的化學方程式為 。
(2)實驗①的目的是 。
(3)實驗②未觀察到預期的實驗現象,為了幫助該同學達到實驗目的,你提出的對上述操作的改進意見是 (用實驗中提供的試劑)。
(4)對于H2O2分解反應,Cu2+也有一定的催化作用.為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答相關問題:

①定性分析:如圖甲可通過觀察 ,定性比較得出結論。有同學提出將FeCl3改為Fe2(SO4)3更為合理,其理由是 。
②定量分析:用圖乙所示裝置做對照實驗,實驗時均以生成40 mL氣體為準,其他可能影響實驗的因素均已忽略。實驗中需要測量的數據是_________________________。
【答案】(1)2H2O2 ![]() 2H2O+O2↑ (寫成MnO2不給分)
2H2O+O2↑ (寫成MnO2不給分)
(2)研究溫度對H2O2分解速率的影響
(3)將兩支試管同時放入盛有相同溫度熱水的燒杯中或 向兩支試管中同時滴入2滴1mol/LFeCl3溶液,觀察產生氣泡的速率
(4)① 溶液中氣泡產生的速率;排除Cl— 的干擾(或 排除了陰離子的不同帶來的干擾,合理即可) ② 收集40mL氣體所需的時間
【解析】
試題分析:(1)過氧化氫分解生成水和氧氣,該反應的化學方程式為2H2O2 ![]() 2H2O+O2↑。
2H2O+O2↑。
(2)分析實驗①的過程可以知道,該實驗是在不同的溫度下進行實驗,所以可以判斷該實驗是驗證溫度對過氧化氫分解速率的影響的,即實驗①的目的是研究溫度對H2O2分解速率的影響;
(3)過氧化氫溶液的分解速率較慢,所以可以借助于硫酸銅溶液來進行判斷,故可以設計實驗如下:將兩支試管同時放入盛有相同溫度熱水的燒杯中,或向兩支試管中同時滴入相同滴數、濃度一樣的硫酸銅溶液,產生氣泡的速率快的是10%的H2O2溶液,反之是5%的H2O2溶液。
(4)①如果定性分析,則可以根據產生氣泡的速率來進行判斷反應的快慢。由于加入的氯化鐵和硫酸銅中陰離子不同,所以為排除氯離子的干擾,可以將FeCl3改為Fe2(SO4)3。
②如果定量分析反應的快慢,則可以通過測定收集40mL的氣體所需的時間進行判斷,時間短則反應快。


 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:
【題目】按要求寫出:
(1)一核10電子的陽離子的符號_________;
(2)兩核10電子的陰離子的電子式___________;
(3)三核10電子的共價化合物的電子式_______;
(4)四核10電子的陽離子的電子式:__________;
(5)四核10電子的共價化合物的結構式_________;
(6)五核10電子的陽離子的化學式___________;
(7)五核10電子的共價化合物的結構式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,回答下列問題(答題時用具體元素符號表示)。
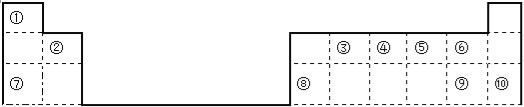
(1)用數字標注的元素中原子半徑最小的是 ,半徑最大的是 ,化學性質最穩定的是 ,非金屬性最強的是 ,最高價氧化物對應的水化物酸性最強的是 。
(2)③最高價氧化物的結構式 ,⑦單質在⑤單質中燃燒產物的電子式
(3)工業制取單質⑦的化學方程式
實驗室制取單質⑨的化學方程式
單質⑧與單質⑦的最高價氧化物對應的水化物的離子方程式:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學一選修5:有機化學基礎]鈴蘭醛具有甜潤的百合香味,對皮膚的刺激性小,對堿穩定,廣泛用于百合、丁香、玉蘭、茶花以及素心蘭、東方型香型日用香精的合成。常用作肥皂、洗滌劑的香料,還可用作花香型化妝品的香料。其合成路線如下圖所示:

(1)B中官能團的名稱是 ;
(2)④的反應類型是 ;
(3)寫出反應②的化學方程式 ;
(4)烏洛托品的結構式如圖所示,其二氯取代物有 種;

將甲醛的水溶液與氨水混合蒸發可制得烏洛托品,該反應的化學方程式 ;
(5)寫出滿足下列條件的A的同分異構體
Ⅰ.有兩個取代基; Ⅱ.取代基在鄰位。
(6)已知:![]() 。仿照上述流程,寫出以CH3CH2CHO為原料制備聚乳酸
。仿照上述流程,寫出以CH3CH2CHO為原料制備聚乳酸 的合成路線流程圖(無機試劑可以任選):
的合成路線流程圖(無機試劑可以任選):
CH3CH2CHO→ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅礦是工業煉銅的主要原料,其主要成分為CuFeS2,現有一種天然黃銅礦(含SiO2),為了測定該黃銅礦的純度,甲同學設計了如下圖實驗:

現稱取研細的黃銅礦樣品1.84g,在空氣存在下進行煅燒,生成Cu、Fe3O 4和SO2氣體,實驗后取d中溶液的1/10 置于錐形瓶中,用0.05mol/L 標準碘溶液進行滴定,消耗標準溶液 20mL。
請回答下列問題:
(1)將樣品研細后再反應,其目的是________________________。
(2)裝置a和c的作用分別是_______和________(填標號,可以多選)。
a.除去SO2氣體 b.除去空氣中的水蒸氣 c.有利于氣體混合
d.有利于觀察空氣流速 e.除去反應后多余的氧氣
(3)滴定達終點時的現象是________________________。
(4)上述反應結束后,仍需通一段時間的空氣,其目的是_____________________。
(5)通過計算可知,該黃銅礦的純度為________________________。
乙同學在甲同學實驗的基礎上,設計了兩種與甲不同的吸收方法,并對吸收產物進行有關處理,同樣也測出了黃銅礦的純度。
(6)方法一:用如下圖裝置替代上述實驗裝置 d,同樣可以達到實驗目的是______(填序號)。

(7)方法二:將原裝置 d 中的試液改為Ba(OH)2,但測得的黃銅礦純度卻產生了+1%的誤差,假設實驗操作均正確,可能的原因主要有________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最新研究發現,用隔膜電解法處理高濃度乙醛廢水具有工藝流程簡單、電耗較低等優點,其原理是使乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸,總反應為:2CH3CHO + H2O![]() CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
實驗室中,以一定濃度的乙醛—Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置示意圖如右圖所示。
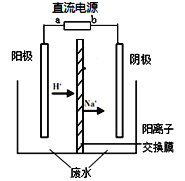
(1)若以甲烷燃料電池為直流電源,則燃料電池中b極應通入 (填化學式)氣體。
(2)電解過程中,兩極除分別生成乙酸和乙醇外,均產生無色氣體。電極反應如下:
陽極:① 4OH--4e-=O2↑+2H2O
② 。
陰極:① 。
②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)電解過程中,陰極區Na2SO4的物質的量 (填“增大”、“減小”或“不變”)。
(4)電解過程中,某時刻測定了陽極區溶液中各組分的物質的量,其中Na2SO4與CH3COOH的物質的量相同。下列關于陽極區溶液中各微粒濃度關系的說法正確的是 (填字母序號)。
a. c(Na+)不一定是c(SO42-)的2倍
b. c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c. c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d. c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸點分別為20.8℃、78.4℃。從電解后陰極區的溶液中分離出乙醇粗品的方法是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】體育競技中服用興奮劑既有失公平,也敗壞了體育道德。某種興奮劑的結構簡式如圖所示。有關該物質的說法中,正確的是( )
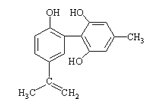
A.滴入酸性高錳酸鉀溶液振蕩,紫色褪去,能證明其結構中存在碳碳雙鍵
B.1mol該物質分別與濃溴水和H2反應時最多消耗溴水和H2分別為4mol和7mol
 C.該物質與苯酚屬于同系物,遇FeCl3溶液呈紫色
C.該物質與苯酚屬于同系物,遇FeCl3溶液呈紫色
D.該分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮、硫的化合物與人類生活和生產有著密切的聯系。請回答下列問題:
(1)在空氣質量報告的各項指標中,有SO2和NO2的指數,SO2是一種無色有毒氣體,NO2是一種 (填“無色”或“紅棕色”)有毒氣體;
(2)氨氣極易溶于水,其水溶液顯 (填“酸”、“堿”或“中”)性;
(3)加熱時,濃硫酸可與碳發生反應:C+2H2SO4(濃)![]() CO2↑+2SO2↑+2H2O。在該反應中,濃H2SO4表現出 (填“吸水”、“脫水”或“氧化”)性。
CO2↑+2SO2↑+2H2O。在該反應中,濃H2SO4表現出 (填“吸水”、“脫水”或“氧化”)性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用軟錳礦(主要成分為MnO2)生產高錳酸鉀產生的錳泥中,還含有18%的MnO2、3%的KOH(均為質量分數),及少量Cu、Pb的化合物等,用錳泥可回收制取MnCO3,過程如圖:

(1)高錳酸鉀的氧化性強弱與溶液的酸堿性有關,在酸性條件下其氧化性較強。通常用來酸化高錳酸鉀的酸是
(2)除去濾液1中Cu2+的離子方程式是
(3)經實驗證明:MnO2稍過量時,起始H2SO4、FeSO4混合溶液中c(H+)/![]() <0.7時,濾液1中能夠檢驗出有Fe
<0.7時,濾液1中能夠檢驗出有Fe![]() ;
;![]() ≥0.7時,濾液1中不能檢驗出有Fe2+。根據上述信息回答①②③:
≥0.7時,濾液1中不能檢驗出有Fe2+。根據上述信息回答①②③:
①檢驗Fe2+是否氧化完全的實驗操作是__________。
②生產時H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之間,不宜過大,請從節約藥品的角度分析,原因是__________。
③若c(H+)/c(Fe2+)>1,調節c(H+)/c(Fe2+)到0.7~1的最理想試劑是_(填序號)
a.NaOH溶液 B.鐵粉 c.MnO。
(4)寫出濾液2中加入過量NH4HCO3反應的離子方程式__________。
(5)上述過程錳回收率可達95%,若處理1740 kg的錳泥,可生產MnCO3__________kg。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com