
【題目】(1)如圖的氮循環是生態系統物質循環的重要部分,人類活動加劇了氮循環中的物質轉化。
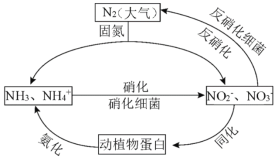
①下列說法正確的是_______(填字母序號)
A.固氮過程中,N2只做氧化劑
B.硝化過程需要有氧化劑參與
C.反硝化過程有助于彌補人工固氮對氮循環造成的影響
D.同化、氨化過程中,實現了氮元素在無機物和有機物之間的轉化
②反硝化過程中,CH3OH可作為反應的還原劑,1mol還原劑失去6mol電子。請將該反應的離子方程式補充完整:5CH3OH+□NO3—![]() □_______+□_______+□_______+□_______,_____________
□_______+□_______+□_______+□_______,_____________
(2)研究表明,氮氧化物(NOx)和二氧化硫都與大氣中霧霾的形成有關。
①已知:SO2生成SO3總反應方程式是2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ/mol
2SO3(g)ΔH=-196.6kJ/mol
此反應可通過如下兩步完成:2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ/mol
2NO2(g)ΔH1=-113kJ/mol
NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH2=_______。
SO3(g)+NO(g)ΔH2=_______。
②一定溫度下,向2L恒容密閉容器中充入NO2和SO2各1mol,5min達到平衡,此時容器中NO2和NO的濃度之比為1∶3,則NO2的平衡轉化率是_______。
(3)砷(As)是第四周期ⅤA族元素,其化合物,有著廣泛的用途。
①AsH3的穩定性比NH3的穩定性_______(填“強’’或“弱’’)。用原子結構解釋原因_______。
②常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫。寫出發生反應的化學方程式_______。
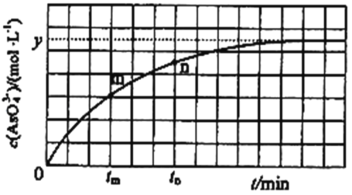
③298K時,將20mL3xmolL-1Na3AsO3、20mL3xmolL-1I2和20mLNaOH溶液混合,發生反應:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)與反應時間(t)的關系如圖所示。若平衡時溶液的pH=14,則該反應的平衡常數K為_______。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43﹣)與反應時間(t)的關系如圖所示。若平衡時溶液的pH=14,則該反應的平衡常數K為_______。
【答案】BCD 5CH3OH+6NO3-![]() N2↑+4HCO3-+CO32-+8H2O —41.8kJ/mol 75% 弱 N和As位于同一主族,As的電子層數比N的多,原子半徑As比N的大,得電子能力As比N弱,非金屬性As比N弱,氫化物AsH3的穩定性比NH3弱 2As2S3+5O2+6H2O=4H3AsO4+6S
N2↑+4HCO3-+CO32-+8H2O —41.8kJ/mol 75% 弱 N和As位于同一主族,As的電子層數比N的多,原子半徑As比N的大,得電子能力As比N弱,非金屬性As比N弱,氫化物AsH3的穩定性比NH3弱 2As2S3+5O2+6H2O=4H3AsO4+6S ![]()
【解析】
(1)①A.氮氣在大氣中氧化為亞硝酸根離子、硝酸根離子,N的化合價升高,被氧化,所以N2作還原劑,故A錯誤;
B.NH3轉化成HNO2,增加了O元素,則NH3被氧氣氧化,所以在硝化細菌作用下發生的硝化過程需要有氧化劑參與,故B正確;
C.反硝化過程,生成氮氣,向大氣提供氮氣,即反硝化過程有助于彌補人工固氮對氮循環造成的影響,故C正確;
D.氨化過程是動植物蛋白轉化為氨氣或銨根離子,即有機物轉化為無機物,同化、氨化過程中,實現了氮元素在無機物和有機物之間的轉化,故D正確;
故選BCD。
②反硝化過程中,CH3OH可作為反應的還原劑,1mol還原劑失去6mol電子。CH3OH與硝酸根離子反應生成氮氣、碳酸根離子、碳酸氫根離子和水,反應的離子方程式為:5CH3OH+6NO3-![]() N2↑+4HCO3-+CO32-+8H2O,故答案為:5CH3OH+6NO3-
N2↑+4HCO3-+CO32-+8H2O,故答案為:5CH3OH+6NO3-![]() N2↑+4HCO3-+CO32-+8H2O;
N2↑+4HCO3-+CO32-+8H2O;
(2)①Ⅰ.2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-196.6kJ·mol-1
2SO3(g)ΔH=-196.6kJ·mol-1
Ⅱ.2NO(g)+O2(g)![]() 2NO2(g)ΔH1=-113kJ·mol-1
2NO2(g)ΔH1=-113kJ·mol-1
蓋斯定律計算(Ⅰ-Ⅱ)×![]() 得到NO2(g)+SO2(g)
得到NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH2=-41.8 kJ·mol-1,故答案為:-41.8 kJ·mol-1;
SO3(g)+NO(g)ΔH2=-41.8 kJ·mol-1,故答案為:-41.8 kJ·mol-1;
②一定溫度下,向2 L恒容密閉容器中充入NO2和SO2各1 mol,5min達到平衡,此時容器中NO2和NO的濃度之比為1:3,結合三行計算列式得到,設消耗NO2的物質的量為x:
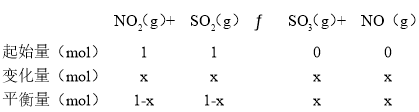
NO2和NO的濃度之比為1:3,物質的量之比=1:3,(1-x):x=1:3,x=0.75mol,NO2的平衡轉化率=![]() ×100%=75%,
×100%=75%,
故答案為:75%;
(3)①非金屬性:N>As,AsH3的穩定性比NH3的穩定性弱,用原子結構解釋原因:N和As位于同一主族,As的電子層數比N的多,原子半徑As比N的大,得電子能力As比N弱,非金屬性As比N弱,氫化物AsH3的穩定性比NH3弱;
②常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫,結合電子轉移配平得方程式為:2As2S3+5O2+6H2O=4H3AsO4+6S;
故答案為:2As2S3+5O2+6H2O=4H3AsO4+6S;
③列三段式如下:
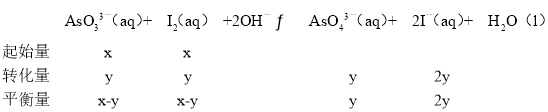
根據平衡常數表達式K=![]() =
=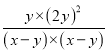 =
=![]() ,故答案為:
,故答案為:![]() 。
。


 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:
【題目】亞硝酸鹽與鈷(Ⅲ)形成的一種配合物[Co(NH3)5NO2]Cl2的制備流程如下:
CoCl2·6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+基態核外電子排布式為___。
(2)配合物[Co(NH3)5Cl]Cl2中與Co3+形成配位鍵的原子為___(填元素符號);配離子[Co(NH3)5NO2]2+的配體中氮原子的雜化軌道類型為___。
(3)NO![]() 的空間構型為___,與它互為等電子體的分子為___(寫化學式)。
的空間構型為___,與它互為等電子體的分子為___(寫化學式)。
(4)H2O2與H2O可以任意比例互溶,除因為它們都是極性分子外,還因為___。
(5)1mol[Co(NH3)5Cl]Cl2中含有σ鍵的數目為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池是化學對人類的一項重大貢獻。
(1)某興趣小組為研究原電池原理,設計如圖裝置。a和b不連接時,燒杯中發生反應的離子方程式為__________。
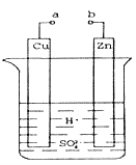
(2)a和b用導線連接,Cu極為原電池_____(填“正”或“負”)極,電極反應式是_______,發生_______(填“氧化”或“還原”)反應。
(3)在實驗中,甲同學發現不僅在銅片上有氣泡產生,而且在鋅片上也產生了氣體,分析原因可能是_______。
(4)如果把鋅片換成石墨,發現電流計指針幾乎不能偏轉,原因_____。
(5)如果把硫酸換成硫酸銅溶液,猜測____(填“鋅極”或“銅極”)變粗,原因是____(用電極方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據反應8NH3+3Cl2=6NH4Cl+N2,回答下列問題。
(1)氧化劑______,還原劑________
(2)氧化產物______,還原產物_______
(3)氧化劑與還原劑的物質的量之比:_________________________
(4)用單線橋的方法表示該反應的電子轉移情況。________________________
(5)用雙線橋的方法表示該反應的電子轉移情況。_________________________
(6)當有8mol NH3參加反應時,轉移的電子數目為__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有下列物質 ①NaCl晶體②液態SO2 ③純醋酸 ④硫酸鋇⑤銅 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 請用以上物質的序號回答下列問題:
屬于強電解質的是________; 屬于弱電解質的是_______;在上述狀態下能導電的物質是_________。
(2)化學平衡移動原理同樣也適用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固體時,平衡____________移動,(填“向右”或“向左”),c(OH-)____(填“增大”或“減小”,下同)。
②向氨水中加入MgCl2固體時,平衡_____移動,(填“向右”或“向左”), c(NH4+)____(填“增大”或“減小”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成藥物鹽酸普羅帕酮的中間體E和雙酚A型聚碳酸酯H的路線:
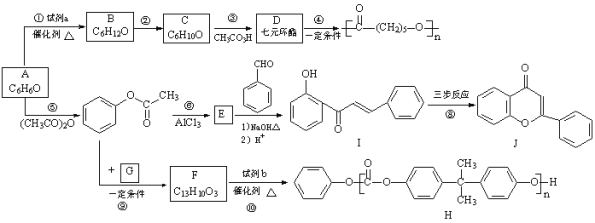
已知:i.![]()
ii.![]()
(1)A的結構簡式是__________。
(2)試劑a是__________。
(3)C只含有一種官能團,反應②的化學方程式是__________。
(4)反應⑤的反應類型是__________。
(5)E中官能團是__________。
(6)下列說法正確的是:__________(填字母序號)。
a.反應③中C發生氧化反應
b.可用FeCl3溶液檢驗反應⑤中A是否反應完全
c.反應⑥的反應物與生成物互為同分異構體
d.反應⑩中試劑b的結構簡式是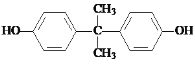
e.反應④是縮合聚合反應,生成了聚酯
(7)I→J轉化的一種路線如圖,已知中間產物2轉化為J是消去反應,寫出中間產物1和中間產物2的結構簡式。
![]()
中間產物1:__________;中間產物2:__________。
(8)G的分子式為C3H6O3,只含一種官能團,且核磁共振氫譜只有一種化學環境的氫,反應⑨的化學方程式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表為元素周期表的一部分,請回答有關問題:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)表中最活潑的金屬是___________,非金屬性最強的元素是____________。(填寫元素符號,下同)
(2)表中能形成兩性氫氧化物的元素是_______________,分別寫出該元素的氫氧化物與⑥、⑨最高價氧化物對應水化物反應的化學方程式:___________、___________。
(3)⑨最高價氧化物對應水化物的電子式______________。
(4)利用下圖裝置來驗證同主族元素非金屬性的變化規律:
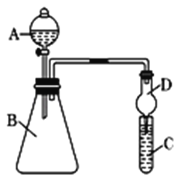
要證明非金屬性:C>Si,在A中加鹽酸,B中加CaCO3,C中加Na2SiO3溶液,應在B、D之間增加一個盛有足量____(選填下列字母:A 濃鹽酸 、B 濃NaOH溶液、C 飽和Na2CO3溶液 、D 飽和NaHCO3溶液)的洗氣裝置.改進后C中發生反應的化學方程式是_____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羥基自由基(·OH,電中性,O 為-1 價)是一種活性含氧微粒。常溫下,利用·OH 處理含苯酚廢水,可將其轉化為無毒的氧化物。
(1)·OH 的電子式為________。
(2) pH=3 時 Fe2+催化 H2O2 的分解過程中產生·OH 中間體,催化循環反應如下。將方程式 ii 補充完整。
i.Fe2++ H2O2+H+ = Fe3++ H2O +·OH
ii.___ + ___= ___+ O2↑+2H+
(3)已知:羥基自由基容易發生猝滅 2·OH = H2O2,從而活性降低.用 H2O2 分解產生的·OH 脫除苯酚,當其他條件不變時,不同溫度下,苯酚的濃度隨時間的變化如圖 1 所示.0~20 min 時,溫度從40℃上升到 50℃,反應速率基本不變的可能原因是________。
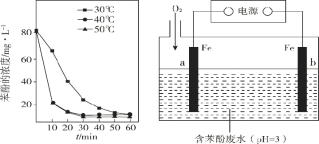
(4)利用電化學高級氧化技術可以在電解槽中持續產生·OH,使處理含苯酚廢水更加高效,裝置如圖2所示。已知 a 極主要發生的反應是 O2 生成 H2O2,然后在電解液中產生·OH 并迅速與苯酚反應。
①b 極連接電源的________極(填“正”或“負”)。
②a 極的電極反應式為______。
③除電極反應外,電解液中主要發生的反應方程式有 ________ , _______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物中間體(G)在有機制藥工業中的一種合成方法如下:
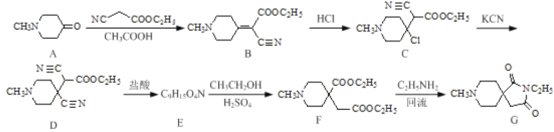
回答下列問題:
(1)化合物D和G中含氧官能團的名稱分別為___________、_________。
(2)由B→C的反應類型為_____ ;寫出C→ D反應的化學方程式:________。
(3)化合物E的結構簡式為________。
(4)反應F→G的另一種生成物是___________。
(5)寫出同時滿足下列條件的B的同分異構體的結構簡式:_______。
①能與新制Cu(OH)2加熱條件下反應生成磚紅色沉淀,水解產物之一能與FeCl3溶液發生顯色反應:
②核磁共振氫譜為四組峰,峰面積比為1:2:4:9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2請設計以HOOCCH2COOH和CH3CH2Cl為原料制備
RCH2NH2請設計以HOOCCH2COOH和CH3CH2Cl為原料制備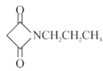 的合成路線:_________(無機試劑任用)。
的合成路線:_________(無機試劑任用)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com