
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
| 0.1×(0.4)4 |
| (0.3)2 |
| 0.1×(0.4)4 |
| (0.3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
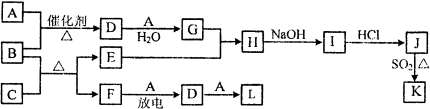
| 時間/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化學 來源:2010年江蘇省徐州市高三第三次調研考試(化學試題) 題型:填空題
本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩
個選修模塊的內容。請選擇其中一題作答。若兩題都做,則按A題評分。
A.微粒A、B、C為分子,D和F為陽離子,E為陰離子,它們都含有lO個電子;B溶
于A后所得的物質可電離出D和E;C是重要的化石能源。將A、B和含F離子的物
質混合后可得D和一種白色沉淀。 離子與Ar原子的電子層結構相同。請回答:
離子與Ar原子的電子層結構相同。請回答:
(1)基態G原子的外圍電子排布式是 。在A、B、C這三種分子中,屬于非極
性分子的有 (寫化學式)。
(2)下列有關B的說法中正確的是 。(填字母)
a.在配合物中可作為配體 b.該分子的穩定性與氫鍵有關
c.分子由各原子最外層均為8 。的穩定結構
。的穩定結構
d.含1 mol B的液體中有3 mol氫鍵
(3)根據等電子體原理,D離子的空間構型是 ,其中心原子軌道的雜化類型
是 。
(4)構成C的中心原子可以形成多種單質,其中有一種為空間網狀結
構,右圖立方體中心的“●”表示該晶體中的一個原子,請在該
立方體的頂點上用“●”表示出與之緊鄰的原子。
(5)光譜證實F與燒堿溶液反應有Na[F(OH)4]生成,則Na[F(OH)4]中
不存在 。(填字母)
a.金屬鍵 b.離子鍵 c.非極性鍵 d.極性鍵
f.配位鍵 g. 鍵 h.
鍵 h. 鍵
鍵
B.對氨基苯磺酸是制取某些染料和藥物的重要中間體,可由苯胺磺化得到:
實驗室可用苯胺、濃硫酸為原料,利用右圖所示實驗裝置合成。
實驗步驟如下:
①取一個250mL的儀器a,加入10mL苯胺及幾粒沸石,
放人冷水中冷卻,小心地加入18 mL濃硫酸。再分別
裝上冷凝管、溫度計等。
②將a置于油浴中緩慢加熱至170`180℃,維持此溫度約2.5 h。
③將反應產物冷卻至約50℃后,倒入盛有100  ,冷水的燒杯中,用玻璃棒不斷攪拌,促使晶體析出。用該燒杯中的少量冷水將a內殘留的產物沖洗到燒杯中,抽濾,用少量冷水洗滌,得到粗產品。
,冷水的燒杯中,用玻璃棒不斷攪拌,促使晶體析出。用該燒杯中的少量冷水將a內殘留的產物沖洗到燒杯中,抽濾,用少量冷水洗滌,得到粗產品。
④將粗產品用沸水溶解,冷卻結晶(若溶液顏色過深,可用活性炭脫色),抽濾,收集
產品,晾干。(提示:100mL水在20℃時可溶解對氨基苯磺酸1.08 g,在100℃時可
溶解6.67 g)
(1)儀器a的名稱是 。步驟①中加入沸石的作用是 。
(2)步驟②中采用油浴加熱,下列說法正確的是 。(填字母)
A.便于控制溫度 B.也可以改用水浴加熱 C.溫度計的水銀球也可浸在油中
(3)步驟③用冷水洗滌的優點是 。
(4)步驟③和④均進行了抽濾操作,在抽濾完畢停止抽濾時,應注意先一二,然
后 。
(5)步驟④有時需重復進行多次,其目的是 。
查看答案和解析>>
科目:高中化學 來源:2014屆浙江省高一上學期期中考試化學試卷 題型:實驗題
(20分)氯氣是一種重要的化工原料,自來水的消毒、農藥的生產、藥物的合成等都需要用到氯氣。工業上通常采用電解法制氯氣:觀察下圖,回答:
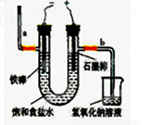
Ⅰ(1)若飽和食鹽水中含有酚酞,通電后_____(填a或b)側先變紅。
(2)電解反應的化學方程式為__________________
Ⅱ某學生設計如下圖所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應),據此回答下列問題:
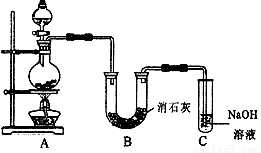
(1) 在A裝置中用固體二氧化錳與濃鹽酸在加熱條件下制取氯氣,反應化學方程式為 ,若在標準狀態下收集到22.4升的氯氣,則被氧化的HCl的物質的量是 。
(2) 漂白粉將在U形管中產生,其化學方程式是 。
(3) C裝置的作用是 。
(4) 此實驗所得漂白粉的有效成分偏低,該學生經分析并查閱資料發現,主要原因是在U形管中還存在兩個副反應。
①溫度較高時氯氣與消石灰反應生成Ca(ClO3)2,為避免此副反應的發生,可采取的措施是 。
②試判斷另一個副反應(用化學方程式表示) 。為避免此副反應的發生,可將裝置作何改進 。
(5)家庭中使用漂白粉時,為了增強漂白能力,可加入少量的物質是 。
A.食鹽 B.食醋 C.燒堿 D.純堿
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
平衡指的是兩個相反方向的變化最后所處的運動狀態;中學階段涉及的平衡有氣
體可逆反應的平衡、酸堿電離平衡、水解平衡及沉淀—溶解平衡等等。
(1)現有容積為2L的恒溫恒容密閉容器,向其中加入2molA氣體和2molB氣體后發
生如下反應: A(g)十B(g)![]() C(g)
C(g) ![]()
20s后,反應達到平衡狀態,生成lmolC氣體,放出熱量Q1kJ。回答下列問題。
①計算 20s內B氣體的平均化學反應速率為 ,求出該反應的平衡常數
。
②保持容器溫度和容積不變,若改為向其中加入1molC氣體,反應達到平衡時,吸收熱量QkJ,則Q1與Q2的相互關系正確的是 (填字母)。
(A)Ql+Q2=a (B)Q1+2Q2<2a (C) Q1+2Q2>2a (D) Ql+Q2<a
(2)甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上可用合成氣制備甲醇。反應為CO(g)+2H2(g)![]() CH3OH(g)某溫度下,在容積為2L的密閉容器中進行該反應,其相關 其相關數據見下圖:
CH3OH(g)某溫度下,在容積為2L的密閉容器中進行該反應,其相關 其相關數據見下圖:

①tmin至2tmin時速率變化的原因可能是 ;
②3tmin時對反應體系采取了一個措施,至4tmin時CO的物質的量為0.5mol,請完成上圖CO的變化曲線。
(3)常溫下,將VmL、0.1000mol·L-1氫氧化鈉溶液逐滴加入到20.00mol·L-1醋酸
溶液中,充分反應。回答下列問題。(忽略溶液體積的變化)
①如果溶液pH=7,此時V的取值 20.00(填“>”、“<”或“="),而溶液中。c(Na+)、
以![]() 的大小關系;
的大小關系;
。
②如 果 V=40.00,則 此 時 溶液 中 ![]()
mol·L-1
(4)某溫度條件下,若將CO2(g)和H2(g)以體積比1:4混合,在適當壓強和催化劑
作用下可制得甲烷,己知:
![]()
則CO2(g)和H2(g)反應生成液態水的熱化學方程式為:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com