
【題目】為探究固體A的組成和性質,設計實驗并完成如下轉化。

已知:X由兩種化合物組成,若將X通入品紅溶液,溶液褪色。若將X通入足量雙氧水中,X可全部被吸收且只得到一種強酸,再稀釋到1000mL,測得溶液的PH=1。在溶液2中滴加KSCN溶液,溶液呈血紅色。請回答:
(1)固體A的化學式______________。
(2)寫出反應①的化學方程式____________。
(3)寫出反應④中生成A的離子方程式______________。
【答案】FeSO42FeSO4![]() Fe2O3+SO2↑+SO3↑2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
Fe2O3+SO2↑+SO3↑2Fe3++SO32-+H2O=2Fe2++SO42-+2H+
【解析】
本題考查無機物的推斷以及實驗方案設計。X由兩種化合物組成,若將X通入品紅溶液,溶液褪色,能使品紅溶液褪色的有SO2,若將X通入足量雙氧水中,X可全部被吸收且只得到一種強酸,根據化學反應SO2+H2O2 =H2SO4 、SO3+H2O =H2SO4可知,X由SO2 和SO3兩種氣體組成。在溶液2中滴加KSCN溶液,溶液呈紅色,說明溶液中有Fe3+,紅棕色固體是氧化鐵。
(1)根據上述分析,固體A加熱分解生成SO2、SO3和氧化鐵,硫元素的化合價降低,鐵元素的化合價升高,則A為FeSO4。
(2)根據上述分析,反應①的化學方程式為2FeSO4![]() Fe2O3+SO2↑+SO3↑ 。
Fe2O3+SO2↑+SO3↑ 。
(3)氣體X為SO2、SO3的混合物氣體,通入NaOH溶液中發生反應生成硫酸鈉和亞硫酸鈉,亞硫酸根離子具有還原性,氧化鐵和硫酸反應生成硫酸鐵,溶液2為硫酸鐵,Fe3+具有氧化性,SO32-與Fe3+能發生氧化還原反應生成Fe2+和SO42-,根據得失電子守恒、電荷守恒和原子守恒配平,則反應④中生成A的離子方程式為2Fe3++SO32-+H2O=2Fe2++ SO42- + 2H+。


科目:高中化學 來源: 題型:
【題目】在一定條件下,將3 mol A和1 mol B兩種氣體混合于2L恒容密閉容器中,發生如下反應:3A(g) + B(g)![]() xC(g)+2D(g)。2 min末該反應達到平衡,生成0.8 mol D,并測得C的濃度為0.2 mol.L-l。下列判斷正確的是( )
xC(g)+2D(g)。2 min末該反應達到平衡,生成0.8 mol D,并測得C的濃度為0.2 mol.L-l。下列判斷正確的是( )
A. A的轉化率為40%
B. 2 min內B的反應速率為0.2 mol.L-l.min-1
C. x=2
D. 若混合氣體的密度不變,則表明該反應已達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示:△H1=-393.5kJmol-1,△H2=-395.4kJmol-1,下列說法正確的是( )
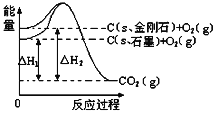
A. 石墨轉化為金剛石是放熱反應
B. 石墨和金剛石的相互轉化是物理變化
C. 金剛石的穩定性強于石墨
D. 等質量的石墨與金剛石完全燃燒,金剛石放出的能量更多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應N2+3H2=2NH3的能量變化如圖所示,該反應的熱化學方程式是

A.N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
D.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據某種共性,可將CO2、SO2歸為一類氧化物。下列物質中,也屬于同類氧化物的是( )
A.CaCO3 B.SO3 C.CuO D.KMnO4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A.金屬氧化物不一定是堿性氧化物
B.HC1、H2S、NH3都是電解質
C.強酸強堿都是離子化合物
D.FeBr3、FeCl2、CuS都不能直接用化合反應制備
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質性質的比較,結論正確的是
A. 溶解度:Na2CO3<NaHCO3
B. 熱穩定性:HCl<PH3
C. 沸點:HCl<HBr
D. 堿性:LiOH<Be(OH)2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com