
【題目】現有反應:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃時,平衡常數K=1.現在850℃時,向2L的密閉容器中充入CO、H2O(g)各4mol,試回答下列問題(寫出具體的計算過程):
(1)達平衡時,CO轉化率為多少?
(2)H2的體積分數為多少?
(3)若溫度仍為850℃,初始時CO濃度為2mol/L,H2O(g)為6mol/L,則平衡時CO轉化率為多少?
【答案】
(1)解:設轉化CO的濃度為x,850℃時,向2L的密閉容器中充入CO、H2O(g)各4mol,列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
c始:2 2 0 0
c轉:x x x x
c平:2﹣x 2﹣x x x
在850℃時,平衡常數K=1.則 ![]() =1,解得x=1,
=1,解得x=1,
平衡時,CO轉化率為 ![]() =50%;
=50%;
答:達平衡時,CO轉化率為50%
(2)解:H2的體積分數為 ![]() =25%;
=25%;
答:H2的體積分數為25%
(3)解:初始時CO濃度為2mol/L,H2O(g)為6mol/L,則平衡時CO轉化了y,
CO(g)+H2O(g)CO2(g)+H2(g)
c始:2 6 0 0
c轉:y y y y
c平:2﹣y 6﹣y y y
溫度不變,則K不變,有 ![]() =1,解得y=1.5,CO轉化率為
=1,解得y=1.5,CO轉化率為 ![]() =75%;
=75%;
答:850℃,初始時CO濃度為2mol/L,H2O(g)為6mol/L,則平衡時CO轉化率為75%
【解析】設轉化CO的濃度為x,850℃時,向2L的密閉容器中充入CO、H2O(g)各4mol,列三段式:
CO(g)+H2O(g)CO2(g)+H2(g)
c始:2 2 0 0
c轉:x x x x
c平:2﹣x 2﹣x x x
在850℃時,平衡常數K=1.則 ![]() =1,解得x=1,
=1,解得x=1,
據此計算CO的轉化率;氫氣的體積分數;溫度不變,K不變,計算初始時CO濃度為2mol/L,H2O(g)為6mol/L,則平衡時CO轉化率.


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】物質在水中可能存在電離平衡、鹽的水解平衡和沉淀的溶解平衡,它們都可看作化學平衡.
請根據所學知識的回答:
(1)濃度為0.1mol/L的8種溶液:①HNO3 ②H2SO4③HCOOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl 溶液pH值由小到大的順序是(填寫編號) .
(2)B為0.1molL﹣1NaHCO3溶液,實驗測得NaHCO3溶液的pH>7,請用離子方程式表示其原因: .
(3)在0.10molL﹣1硫酸銅溶液中加入氫氧化鈉稀溶液充分攪拌有淺藍色氫氧化銅沉淀生成,當溶液的pH=8時,c(Cu2+)=(已知Ksp[Cu(OH)2]=2.2x10﹣20).若在0.10molL﹣1硫酸銅溶液中通入過量H2S氣體,使Cu2+完全沉淀為CuS,此時溶液中的H+濃度是.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為;
(2)反應是反應.(選填“吸熱”、放熱).
(3)能判斷該反應是否達到化學平衡狀態的依據是 .
a.容器中壓強不變 b.混合氣體中c(CO)不變
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),試判斷此時的溫度為℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重鉻酸鉀是一種重要的化工原料,工業上由鉻鐵礦(主要成分為FeOCr2O3、SiO2等)制備,制備流程如圖所示:

已知:a.步驟①的主要反應為: 2FeOCr2O3+4Na2CO3+ 7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 b. 2CrO42-+2H+
4Na2CrO4+Fe2O3+4CO2+7NaNO2 b. 2CrO42-+2H+ ![]() Cr2O72-+H2O
Cr2O72-+H2O
下列說法正確的是
A. 步驟①熔融、氧化可以在陶瓷容器中進行
B. 步驟①中每生成44.8L(標況下) CO2共轉移14mol電子
C. 步驟④若調節濾液2的pH使之變大,則有利于生成Cr2O72-
D. 步驟⑤生成K2Cr2O7晶體,說明該溫度下K2Cr2O7溶解度小于Na2Cr2O7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將SO2分別通入下列4種溶液中,有關說法不正確的是( )
A. 試管a中實驗可以證明SO2具有還原性 B. 試管b中溶液褪色,說明SO2具有漂白性
C. 試管c中能產生白色沉淀,說明SO2具有氧化性 D. 試管d中能產生白色沉淀,該沉淀不溶于稀硝酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組化合物中,氮元素具有相同化合價的是 ( )
A. NO、NO2 B. NO2、N2O C. NH3、NH4Cl D. NO2、HNO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的值,下列說法不正確的是( )
A.NA個O2分子與NA個氖分子的質量比是4∶5
B.11.2L任何氣體有可能為0.5mol
C.12g12C質子數6NA
D.常溫常壓下,4.4gCO2為0.1NA個CO2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的化工原料,能與有機物和無機物進行反應生成多種氯化物。現用下圖裝置制取氯氣并進行一系列的實驗探究。
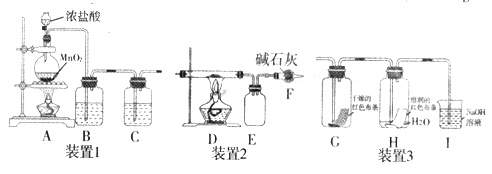
回答下列問題:
(1)裝置1是用來制備純凈、干燥的氯氣:
①裝置A 中圓底燒瓶內發生反應的離子方程式是__________,反應中被氧化的HCl 與消耗的HCl物質的量之比為_______。
②裝置B內試劑為__________,裝置C的作用是_________。
(2)若將裝置1與裝置2連接制備少量氯化鐵固體(氯化鐵易吸水,在300℃時升華),則:
①D中發生反應的化學方程式為______________;
②D、E間導管短且粗的原因是______________;
③若在D裝置的硬質玻璃管內裝入硅藻土和碳粉,則發生如下反應:
SiO2+2C+2Cl2![]() SiCl4+2CO
SiCl4+2CO
當反應消耗6g碳時,反應轉移的電子數為______,F裝置之后還應添加一個裝置用來_______。
(3)將裝置1與裝置3連接來探究氯氣是否具有漂白性。
①將氯氣依次通過盛有干燥紅色布條的廣口瓶和盛有濕潤紅色布條的廣口瓶,可觀察到的現象是________________。
②為防止氯氣尾氣污染空氣,根據氯水顯酸性的性質,可用氫氧化鈉溶液吸收多余的氯氣,原理是(用離子方程式表示___________。根據這一原理,工業上常用廉價的石灰乳吸收工業氯氣尾氣制得漂白粉,漂白粉的有效成分是_________(填化學式),長期露置于空氣中的失效漂白粉,加稀鹽酸后產生的氣體是________(用字母代號填)。
A.O2 B.H2 C.CO2 D.HClO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com