
| 0.02mol/L |
| 0.03mol/L |
| [N2O4] |
| [NO2]2 |
| 0.01mol/L |
| (0.01mol/L)2 |


科目:高中化學(xué) 來源: 題型:
| a |
| 200b |
| a |
| 200b |

查看答案和解析>>
科目:高中化學(xué) 來源:2013屆山東省濟南世紀英華實驗學(xué)校高三上學(xué)期期末考試化學(xué)試卷(帶解析) 題型:填空題
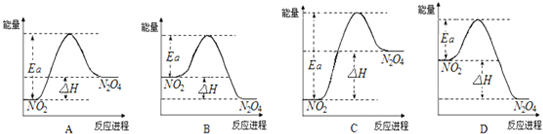
(11分)已知N2O4 (g)  2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
(1)現(xiàn)將1 mol N2O4 充入一恒壓密閉容器中,下列示意圖正確且能說明反應(yīng)達到平衡狀態(tài)的是________。
(2)若在相同溫度下,上述反應(yīng)改在體積為1L的恒容密閉容器中進行,平衡常數(shù)________(填“增大”、“不變”或“減小” )。反應(yīng)3s后NO2的物質(zhì)的量為0.6mol,則0~3s內(nèi)的平均反應(yīng)速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃時,將amol NH4NO3溶于水,溶液顯酸性,原因是 (用離子方程式表示)。向該溶液滴加bL氨水后溶液呈中性,則滴加氨水的過程中的水的電離平衡將______(填”正向”“不”或“逆向”)移動。
查看答案和解析>>
科目:高中化學(xué) 來源:2012-2013學(xué)年江西省高安中學(xué)高二上學(xué)期期末考試化學(xué)試卷(帶解析) 題型:填空題
(共12分)隨著人類對溫室效應(yīng)和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發(fā)利用CO2,引起了各國的普遍重視。
Ⅰ.目前工業(yè)上有一種方法是用CO2來生產(chǎn)燃料甲醇。為探究該反應(yīng)原理,進行如下實驗,在體積為1L的密閉容器中,充入1mol CO2和3.25 mol H2,在一定條件下發(fā)生反應(yīng),測定CO2、CH3OH(g)和H2O(g)的濃度隨時間變化如下圖所示:
(1)從反應(yīng)開始到平衡,氫氣的平均反應(yīng)速率 = mol/(L·min)
= mol/(L·min)
(2)該條件下CO2的轉(zhuǎn)化率為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高溫度 | B.恒容時充入氮氣 |
| C.將水蒸氣從體系中分離 | D.用更有效的催化劑 |

查看答案和解析>>
科目:高中化學(xué) 來源:2014屆江西省高二上學(xué)期期末考試化學(xué)試卷(解析版) 題型:填空題
(共12分)隨著人類對溫室效應(yīng)和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發(fā)利用CO2,引起了各國的普遍重視。
Ⅰ.目前工業(yè)上有一種方法是用CO2來生產(chǎn)燃料甲醇。為探究該反應(yīng)原理,進行如下實驗,在體積為1L的密閉容器中,充入1mol CO2和3.25 mol H2,在一定條件下發(fā)生反應(yīng),測定CO2、CH3OH(g)和H2O(g)的濃度隨時間變化如下圖所示:

(1)從反應(yīng)開始到平衡,氫氣的平均反應(yīng)速率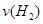 = mol/(L·min)
= mol/(L·min)
(2)該條件下CO2的轉(zhuǎn)化率為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高溫度 B.恒容時充入氮氣
C.將水蒸氣從體系中分離 D.用更有效的催化劑
Ⅱ.下圖是一個乙醇燃料電池工作時的示意圖,乙池中的兩個電極一個是石墨電極,一個是鐵電極,工作時M、N兩個電極的質(zhì)量都不減少,請回答下列問題:

(1)M極的電極材料為 。
(2)加入乙醇的鉑電極的電極反應(yīng)式為 。
(3)在此過程中乙池中某一電極析出金屬銀4.32g時,此時乙池溶液的體積為400mL,則乙池中溶液的pH為 。
(4)若在常溫常壓下,1g C2H5OH燃燒生成CO2和液態(tài)H2O時放出29.71kJ熱量,表示該反應(yīng)的熱化學(xué)方程式為 。
查看答案和解析>>
科目:高中化學(xué) 來源:2012-2013學(xué)年山東省高三上學(xué)期期末考試化學(xué)試卷(解析版) 題型:填空題
(11分)已知N2O4 (g)  2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
(1)現(xiàn)將1 mol N2O4 充入一恒壓密閉容器中,下列示意圖正確且能說明反應(yīng)達到平衡狀態(tài)的是________。

(2)若在相同溫度下,上述反應(yīng)改在體積為1L的恒容密閉容器中進行,平衡常數(shù)________(填“增大”、“不變”或“減小” )。反應(yīng)3s后NO2的物質(zhì)的量為0.6mol,則0~3s內(nèi)的平均反應(yīng)速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃時,將amol NH4NO3溶于水,溶液顯酸性,原因是 (用離子方程式表示)。向該溶液滴加bL氨水后溶液呈中性,則滴加氨水的過程中的水的電離平衡將______(填”正向”“不”或“逆向”)移動。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com