
以甲醇為替代燃料是解決我國石油資源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相關反應的熱化學方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H ="-42.9" kJ·mol-1
則反應CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = kJ·mol-1
反應CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常數K的表達式為 。
(2)用CO2合成甲醇時可選用亞鉻酸鋅(ZnCr2O4)或CuCl為催化劑。
①工業制備亞鉻酸鋅是用CO還原ZnCrO4·H2O,同時生成ZnO。該反應的化學方程式是 。以亞鉻酸鋅為催化劑時,工業上的適宜溫度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固體,制備時向CuCl2溶液中加入過量銅粉,發生反應CuCl2+Cu=2CuC1。在實驗過程中應先加入濃鹽酸,發生反應CuCl + HCl H[CuCl2]。反應結束后將溶液倒入蒸餾水中有CuCl生成。實驗過程中加入濃鹽酸的目的是 。當c(Cl-)=2×10-3 mol·L—1時, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
H[CuCl2]。反應結束后將溶液倒入蒸餾水中有CuCl生成。實驗過程中加入濃鹽酸的目的是 。當c(Cl-)=2×10-3 mol·L—1時, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
(3)直接甲醇燃料電池結構如圖所示,則負極反應是 。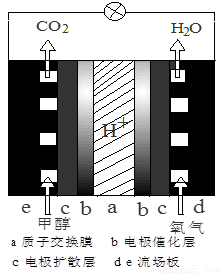
(14分)每空2分
(1)- 59.6 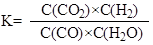
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此時催化劑亞鉻酸鋅的活性最大(或溫度升高,反應速率增大)
②促使平衡正向移動,防止CuCl固體覆蓋在Cu表面,影響反應的進行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
【解析】
試題分析:(1)通過熱化學方程式的疊加,CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= - 59.6。
化學平衡常數等于生成物濃度的冪之積除以反應物難度的冪之積,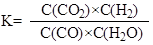 。
。
(2)①根據題中的反應物、生成物,反應的方程式為2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O。
溫度對化學反應的速率影響較大且催化劑需要適當的溫度活性才大,故工業上的適宜溫度是:350℃~420℃,可能的原因是此時催化劑亞鉻酸鋅的活性最大(或溫度升高,反應速率增大)。
②應為加入濃鹽酸會發生CuCl + HCl H[CuCl2],故實驗過程中加入濃鹽酸的目的是,促使平衡正向移動,防止CuCl固體覆蓋在Cu表面,影響反應的進行。
H[CuCl2],故實驗過程中加入濃鹽酸的目的是,促使平衡正向移動,防止CuCl固體覆蓋在Cu表面,影響反應的進行。
Ksp(CuCl)= c(Cl-) ×c(Cu+-)=1.7×10-7,c(Cl-)=2×10-3 mol·L—1,故c(Cu+-)8.5×10-5 mol·L—1。
(3)甲醇燃料電池中,甲醇是負極,失去電子,化合價所給,電極式為CH3OH+H2O-6e-=CO2+6H+。
考點:反應熱的計算 平衡常數的計算 化學方程式的書寫 燃料電池 溶度積 電極式的書寫
點評:本題考查反應熱的計算、平衡常數的計算、化學方程式的書寫、燃料電池、溶度積、電極式的書寫等知識,題目難度較大,注意題中信息的利用。


科目:高中化學 來源: 題型:
 試運用所學知識,解決下列問題:
試運用所學知識,解決下列問題: H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:| 溫度/°C | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年河南省焦作市高三第一次模擬考試理綜化學試卷(解析版) 題型:填空題
有效利用現有資源是解決能源問題的一種實際途徑。發展“碳一化學”,開發利用我國相對豐富的煤炭資源具有重要的戰略意義和經濟價值。下面是以焦炭為原料,經“碳一化學”途徑制取乙二醇的過程:

(1)該過程中產生的的CO可繼續與水蒸氣發生可逆反應得到CO2和H2,此反應的平衡常數表達式K=_____________。
(2)CH3OH(l)氣化時吸收的熱量為27kJ/mol,CH3OH(g)的燃燒熱為677kJ/mol,請寫出CH3OH(l)燃燒熱的熱化學方程式_____________。
(3)“催化還原”反應制乙二醇原理如下: CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
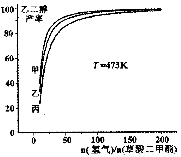
為探究實際生產的最佳條件,某科研小組進行了多方面研究。如圖表示乙二醇達到平衡時的產率隨原料投料比[n(氫氣)/n(草酸二甲酯)]和壓強的變化關系,其中三條曲線分別表示體系壓強為1.5MPa、2.5MPa、3.5MPa的情況,則曲線丙對應的壓強是P(丙)=_____________。
(4)草酸二甲酯水解產物草酸(H2C2O4)為二元中強酸①草酸氫鉀溶液中存? 在如下平衡: H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和____________。
H++C2O42-和____________。
②向0.1mol/L的草酸氫鉀溶液里滴加NaOH溶液至中性,此時溶液中各粒子濃度關系正確的是__________(填序號)。
A.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
B.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
C.c(Na+)=c(H2C2O4)+c(C2O42-)
D.c(K+)>c(Na+)
(5)以甲醇為原料,使用酸性電解質構成燃料電池,該燃料電池的負極反應式為_____________;若以甲烷代替該燃料電池中的甲醇,向外界提供相等電量,則每代替3.2g甲醇,所需標準狀況下的甲烷的體積為____________L。
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

| 溫度/°C | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
| 時間/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |

查看答案和解析>>
科目:高中化學 來源:2011年福建省福州一中高考化學模擬試卷(解析版) 題型:解答題
 H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:| 溫度/°C | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
| 時間/s | 20 | 40 | 60 | 80 | |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com