
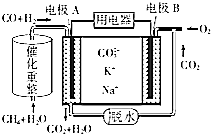
 CH4和H2O(g)可發生催化重整反應:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可發生催化重整反應:CH4(g)+H2O(g)?CO(g)+3H2(g).分析 (1)H2O將CH4氧化為CO,反應中C元素化合價由-4價升高為+2價,化合價總共升高6價,該反應中轉移6e-,結合n=$\frac{m}{M}$解答;
(2)根據已知方程式構建目標方程式④,根據蓋斯定律計算反應熱;
(3)①根據v=$\frac{△c}{△t}$計算v(CH4),再根據速率之比等于化學計量數之比計算v(H2);
②化學平衡常數為生成物濃度系數次冪的乘積與反應物濃度系數次冪乘積的比值;
③當溫度升高到(T+100)℃時,容器中c(CO)=0.75mol•L-1,CO濃度增多,所以平衡向正反應方向移動,升高溫度平衡向吸熱的方向移動,據此分析解答;
(4)CH4+2H2O?CO+3H2,原電池工作時,CO和H2失電子在負極反應,則A為負極,CO和H2被氧化生成二氧化碳和水,正極B上為氧氣得電子生成CO32-,以此解答該題.
解答 解:(1)8gCH4的物質的量為n=$\frac{m}{M}$=$\frac{8g}{16g/mol}$=0.5mol,CH4和H2O(g)可發生催化重整反應:CH4(g)+H2O(g)?CO(g)+3H2(g),反應中C元素化合價由-4價升高為+2價,化合價總共升高6價,該反應中轉移6e-,則0.5molCH4反應轉移3mol電子,
故答案為:3;
(2)①2CO(g)+O2(g)?2CO2(g)△H1=akJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=bkJ•mol-1
③CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H3=ckJ•mol-1
根據蓋斯定律可知:③+②×3-①×2,得到④CH4(g)+2H2O(g)?CO(g)+3H2(g)所以△H4=(c+3b-2a)kJ•mol-1,
故答案為:c+3b-2a;
(3)①向1L恒容密閉容器中投入1molCH4和1molH2O(g),發生反應:CH4(g)+H2O?CO(g)+3H2(g),反應開始c(CH4)=1mol•L-1,經過tmin,反應達到平衡.已知平衡時,c(CH4)=0.5mol•L-1,v(CH4)=$\frac{0.5mol/L}{tmin}$=$\frac{0.5}{t}$mol/(L•min),速率之比等于化學計量數之比,則v(H2)=3v(CH4)=3×$\frac{0.5}{t}$mol/(L•min)=$\frac{1.5}{t}$mol/(L•min),
故答案為:$\frac{1.5}{t}$mol/(L•min);
②T℃時,1L恒容密閉容器中CH4(g)+H2O?CO(g)+3H2(g)
起始量(mol):1 1 0 0
變化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 0.5 0.5 1.5
平衡常數K=$\frac{C(CO)×C({H}_{2})}{C(C{H}_{4})×C({H}_{2}O)}$=$\frac{(\frac{1.5}{t})^{3}×(\frac{0.5}{t})}{\frac{0.5}{t}×\frac{0.5}{t}}$=$\frac{6.75}{{t}^{2}}$=6.75,
故答案為:6.75;
③升高溫度平衡向吸熱的方向移動,T℃時,容器中c(CO)=0.5mol•L-1,當溫度升高到(T+100)℃時,容器中c(CO)=0.75mol•L-1,CO濃度增多,平衡向正反應方向移動,所以正反應為吸熱反應,
故答案為:吸熱;
(4)①原電池工作時,CO和H2失電子在負極反應,則A為負極,CO和H2被氧化生成二氧化碳和水,電池工作時,陽離子向正極移動,B為正極,即K+和Na+向電極B移動,
故答案為:B;
②甲烷和水蒸氣反應CH4+2H2O?CO+3H2,原電池工作時,A為負極,負極上CO和H2失電子發生了氧化反應,CO和H2被氧化生成二氧化碳和水,電極反應為:3H2+CO+4CO32--8e-=3H2O+5CO2,B為正極,正極為氧氣得電子生成CO32-,反應為2O2+4CO2+8e-=4CO32-,
故答案為:3H2+CO+4CO32--8e-=3H2O+5CO2.
點評 本題考查了反應熱的計算、化學平衡的影響因素、化學電源新型電池,掌握蓋斯定律的應用、化學平衡移動的影響因素、明確原電池中物質得失電子、電子流向、離子流向即可解答,難點是電極反應式書寫,要根據電解質確定正負極產物,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固體與足量的稀鹽酸反應,放出熱量為a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水時,放出熱量為b kJ | |
| C. | 因氫氣的燃燒熱為c kJ/mol,故電解水的熱化學方程式為:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2與3 mol H2 充分反應后,放出熱量小于d kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
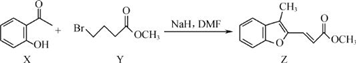
| A. | 物質 X在空氣中不易被氧化 | |
| B. | 物質 Y中只含一個手性碳原子 | |
| C. | 物質 Z中所有碳原子不可能在同一平面內 | |
| D. | 等物質的量的 X、Y分別與 NaOH反應,最多消耗 NaOH的物質的量之比為 1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉著火后,可用泡沫滅火器來滅火 | |
| B. | 氧化鈉和過氧化鈉都屬于堿性氧化物 | |
| C. | 過氧化鈉與水的反應中,Na2O2作氧化劑,水作還原劑 | |
| D. | 用潔凈的玻璃管向包有Na2O2的脫脂棉吹氣,脫脂棉燃燒,說明CO2、H2O與Na2O2的反應是放熱反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com