
【題目】(1)已知:①CO燃燒熱為283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽車尾氣中的NO(g)和CO(g)在一定溫度和催化劑條件下可發生反應,能消除污染,寫出該反應的熱化學方程式______________。
(2)某溫度下,等物質的量的碘和環戊烯(![]() )在剛性容器內發生反應:
)在剛性容器內發生反應:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為____,該反應的平衡常數Kp=____Pa(用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數)。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有____(填標號)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為____,該反應的平衡常數Kp=____Pa(用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數)。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有____(填標號)。
A.通入惰性氣體 B.提高溫度 C.增加環戊烯濃度 D.增加碘濃度
(3)室溫下,煙氣中的SO2可用某濃度的NaOH溶液吸收得到pH=7的溶液,試計算所得溶液中![]() =_____(已知:常溫下H2SO3的電離平衡常數Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常溫下H2SO3的電離平衡常數Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)煙氣中的SO2也可用Na2SO3溶液吸收,吸收過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
當吸收液呈中性時,溶液中離子濃度由小到大的順序為___________。
【答案】2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= -746.5 kJ·mol-1 40% 3.56×104或3.6×104 BD 2.2 c(H+)=c(OH-)<c(SO32-)<c(HSO3-)<c(Na+)
【解析】
(1)根據燃燒熱的定義寫出CO燃燒的熱化學方程式,再根據蓋斯定律分析計算;
(2)設碘和環戊烯(![]() )的初始物質的量都為n mol,轉化的物質的量為x mol,
)的初始物質的量都為n mol,轉化的物質的量為x mol,![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol)n n 0 0
轉化(mol)xx x 2x
平衡(mol)n-x n-x x![]() 2x
2x
剛性容器內氣體的壓強與物質的量成正比,則: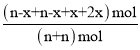 =1+20%,解得:x=0.4n mol,據此計算;達到平衡后,欲增加環戊烯的平衡轉化率,需要使平衡向著正向移動,結合平衡移動原理分析;
=1+20%,解得:x=0.4n mol,據此計算;達到平衡后,欲增加環戊烯的平衡轉化率,需要使平衡向著正向移動,結合平衡移動原理分析;
(3)利用溶液中存在的電荷守恒分析;
(4)吸收液呈中性時,溶質為亞硫酸鈉和亞硫酸氫鈉,電離與水解的程度相等,結合電荷守恒解答。
(1)CO燃燒熱為283.0kJ·mol-l,則有2CO(g)+O2(g) =2CO2(g) ![]() H1= -566 kJ·mol-1(I),
H1= -566 kJ·mol-1(I),
N2(g)+O2(g) =2NO(g) ![]() H2=+180.5kJ·mol-1 (II),則反應I-反應II得2NO(g)+2CO(g)=N2(g)+2CO2(g),對應的
H2=+180.5kJ·mol-1 (II),則反應I-反應II得2NO(g)+2CO(g)=N2(g)+2CO2(g),對應的![]() H=
H=![]() H1-
H1-![]() H2=-566 kJ·mol-1-180.5kJ·mol-1=-746.5 kJ·mol-1,故答案為:2NO(g)+2CO(g)=N2(g)+2CO2(g)
H2=-566 kJ·mol-1-180.5kJ·mol-1=-746.5 kJ·mol-1,故答案為:2NO(g)+2CO(g)=N2(g)+2CO2(g) ![]() H= -746.5 kJ·mol-1;
H= -746.5 kJ·mol-1;
(2)設碘和環戊烯(![]() )的初始物質的量都為n mol,轉化的物質的量為x mol,
)的初始物質的量都為n mol,轉化的物質的量為x mol,![]() (g)+I2(g)=
(g)+I2(g)=![]() (g)+2HI(g)
(g)+2HI(g)
初始(mol)n n 0 0
轉化(mol)xx x 2x
平衡(mol)n-x n-x x 2x
剛性容器內氣體的壓強與物質的量成正比,則: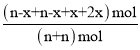 =1+20%,解得:x=0.4n mol,解得:x=0.4n,
=1+20%,解得:x=0.4n mol,解得:x=0.4n,
平衡時環戊烯的轉化率為:![]() ×100%=40%;
×100%=40%;
平衡時混合氣體的壓強為:105Pa×(1+20%)=1.2×105Pa,混合氣體總物質的量為:(n-0.4n+n-0.4n+0.4n+0.4n×2)mol=2.4nmol,
平衡時各組分所占壓強分別為p(![]() )=p(I2)=
)=p(I2)=![]() ×1.2×105Pa=3×104Pa,p(
×1.2×105Pa=3×104Pa,p(![]() )=
)=![]() ×1.2×105Pa=2×104Pa,p(HI)=
×1.2×105Pa=2×104Pa,p(HI)=![]() ×1.2×105Pa=4×104Pa,該反應的平衡常數Kp=
×1.2×105Pa=4×104Pa,該反應的平衡常數Kp=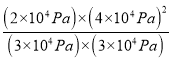 ≈3.56×104Pa(或3.6×104 Pa);
≈3.56×104Pa(或3.6×104 Pa);
A.通入惰性氣體,各組分濃度不變,平衡不移動,則環戊烯的轉化率不變,故A錯誤;
B.該反應為吸熱反應,提高溫度平衡向著正向移動,環戊烯的轉化率增大,故B正確;
C.增加環戊烯濃度,環戊烯的轉化率減小,故C錯誤;
D.增加碘濃度,反應物濃度增大,平衡向著正向移動,環戊烯的轉化率增大,故D正確;
故答案為:40%;3.56×104;BD;
(3)煙氣中的SO2可用某濃度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且得溶液呈中性,依據溶液中電荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),中![]() =
=![]() =
=![]() +1=2.2;
+1=2.2;
(4)根據表格中的數據可知,當c(SO32-=c(HSO3-)時,溶液呈堿性,所以要使吸收液呈中性,c(HSO3-)應稍大些,此時溶質為亞硫酸鈉和亞硫酸氫鈉,c(Na+)最大,則離子濃度為c(H+)=c(OH-)<c(SO32-)<c(HSO3-)<c(Na+)。


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:
【題目】俗名為“臭堿”的硫化鈉廣泛應用于冶金染料、皮革、電鍍等工業。硫化鈉的一種制備方法是Na2SO4+2C![]() Na2S+2CO2↑。設NA為阿伏加德羅常數的數值,下列說法正確的是( )
Na2S+2CO2↑。設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A. 0.1 mol·L-1的Na2SO4溶液中含SO42-的數目為0.1NA
B. 1 mol 13C原子所含中子數為6NA
C. 78 g Na2S中所含離子總數為2NA
D. 標準狀況下,2.24 L CO2所含氧原子數為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化氫分解制取氫氣和硫黃的反應原理為2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒容密閉容器中充入0.1 mol H2S,不同溫度下測得H2S的轉化率與時間的關系如圖所示。下列說法不正確的是
S2(g)+2H2(g),在2.0 L恒容密閉容器中充入0.1 mol H2S,不同溫度下測得H2S的轉化率與時間的關系如圖所示。下列說法不正確的是
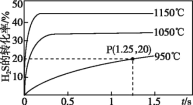
A.正反應為吸熱反應
B.圖中P點:v正>v逆
C.950 ℃時,0~1.25 s生成H2的平均反應速率為0.008 mol·L-1·s-1
D.950 ℃時,該反應的平衡常數的值小于3.125×10-4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A有如下轉化關系:
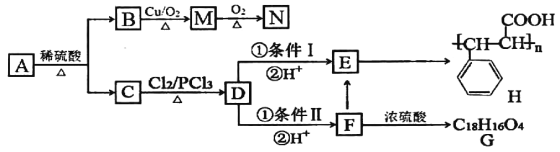
已知:①有機物B是芳香烴的含氧衍生物,其相對分子質量為108,B中氧的質量分數為14.8%。
②CH3-CH2-COOH+Cl2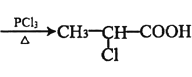 +HCl
+HCl
根據以上信息,回答下列問題:
(1)B的分子式為___________;有機物D中含氧官能團名稱是_____________。
(2)A的結構簡式為_________________ ;檢驗M中官能團的試劑是______________。
(3)條件I為_________________;D→F的反應類型為________________。
(4)寫出下列轉化的化學方程式:
F→E______________________________________
F→G_____________________________________。
(5)N的同系物X比N相對分子質量大14,符合下列條件的X的同分異構體有_________種(不考慮立體異構),寫出其中核磁共振氫譜有五組峰,且吸收峰的面積之比為1∶1∶2∶2∶2的同分異構體的結構簡式______________(寫一種)。
①含有苯環; ②能發生銀鏡反應; ③遇FeCl3溶液顯紫色。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼及硼的化合物有著廣泛的用途。請回答下列問題:
(1)硼酸(H3BO3)在水中電離出陰離子B(OH)4-,請試著寫出硼酸的電離方程式___________。
(2)已知:H3BO3的電離常數Ka=5.8×1010,H2S的電離常數掏Ka1=5.7×108、Ka2=1.2×1015,向飽和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,寫出發生反應的離子方程式_________。
(3)BCl3主要用作半導體硅的摻雜源,遇水強烈水解,0.01mol BCl3溶于300mL蒸餾水中(溶液體積變化忽略不計),則所得溶液的pH值約為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酰乙酸乙酯是有機合成中非常重要的原料,實驗室制備乙酰乙酸乙酯的反應原理、裝置示意圖和有關數據如下所示:

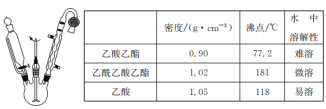
實驗步驟:
Ⅰ.合成:向三頸燒瓶中加入9.8ml無水乙酸乙酯,迅速加入0.1g切細的金屬鈉。水浴加熱反應液,緩慢回流約2h至金屬鈉全部反應完。停止加熱,冷卻后向反應混合物中加入50%乙酸至反應液呈弱酸性。
Ⅱ.分離與提純:
①向反應混合物中加入等體積的飽和食鹽水,分離得到有機層。
②水層用5mL無水乙酸乙酯萃取,分液。
③將①②所得有機層合并,洗滌、干燥、蒸餾得到乙酰乙酸乙酯粗產品。
④蒸餾粗產品得到乙酰乙酸乙酯3.9g。
(1)球形冷凝管中冷卻水從______(填“上”或“下”)口進入,上方干燥管中盛無水CaCl2,其作用是________。
(2)實驗室制備乙酰乙酸乙酯時,通常在無水乙酸乙酯中加入微量的無水乙醇,其作用是___。
(3)分離與提純操作①中使用的分離儀器是________。加入飽和食鹽水的作用是 _______。
(4)分離與提純操作③用飽和NaHCO3溶液洗滌的目的是 _______。
(5)本實驗的產率為_______ %(結果保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環保、安全的鋁—空氣電池的工作原理如下圖所示,下列有關敘述錯誤的是
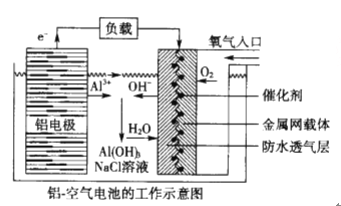
A. NaCl的作用是增強溶液的導電性
B. 正極的電極反應式為: O2+4e-+2H2O=4OH-
C. 電池工作過程中,電解質溶液的pH不斷增大
D. 用該電池做電源電解KI溶液制取1molKIO3,消耗鋁電極的質量為54g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. 澄清石灰水與過量的小蘇打溶液反應:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高錳酸鉀溶液與稀草酸反應:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的懸濁液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入過量NaOH溶液加熱:NH4++OH-===NH3H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com