
| A. | 升高溫度可使吸熱反應的反應速率增大,使放熱反應的反應速率減小 | |
| B. | 決定化學反應速率的主要因素是參加反應的物質的性質 | |
| C. | 對于有氣體參加的反應,增大壓強,反應速度加快 | |
| D. | 恒容容器中,在氣體反應體系中充入稀有氣體,化學反應速率不發生改變 |
分析 A.升高溫度能使所有的化學反應速率加快,與反應熱無關;
B.決定化學反應速率是物質本身的性質;
C.對應有氣體參加的化學反應,增大壓強,物質濃度增大,反應速率加快;
D.恒容容器中,在氣體反應體系中充入稀有氣體,反應物和生成物濃度不變,則化學反應速率不發生改變.
解答 解:A.升高溫度能增大活化分子百分數,所以能使所有的化學反應速率加快,與反應熱無關,故A錯誤;
B.決定化學反應速率是物質本身的性質,外界只是影響因素,故B正確;
C.對應有氣體參加的化學反應,增大壓強,體積減小,物質濃度增大,單位體積內活化分子個數增大多,所以反應速率加快,故C正確;
D.恒容容器中,在氣體反應體系中充入稀有氣體,反應物和生成物物質的量不變、容器體積不變導致反應物和生成物濃度不變,則化學反應速率不發生改變,故D正確;
故選A.
點評 本題考查化學反應速率影響因素,為高頻考點,溫度、濃度、壓強、催化劑、反應物接觸面積等都是影響因素,本身的性質決定其反應速率,易錯選項是A,注意:溫度對化學反應速率的影響與反應熱無關.


 浙江名校名師金卷系列答案
浙江名校名師金卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.2mol•L-1的Na2CO3溶液中離子濃度關系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等體積混合后,若測得溶液中c (Cl-)>c (NH4+),則溶液中有關微粒的濃度關系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,則混合溶液中離子濃度關系為:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中離子濃度關系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入硝酸銀溶液,有白色沉淀生成,證明一定有Cl-存在 | |
| B. | 加入BaCl2溶液和稀硝酸,有白色沉淀生成,證明一定有SO42- | |
| C. | 加入碳酸鈉溶液產生白色沉淀,再加入鹽酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氫氧化鈉溶液并加熱,產生的氣體能使濕潤的紅色石蕊試紙變藍,一定有NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
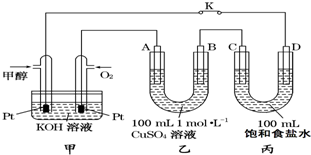 如圖是甲醇(CH3OH)燃料電池工作的示意圖,其中A、B、D均為石墨電極,C為銅電極.工作一段時間后,斷開K,此時A、B兩極上產生的氣體體積相同.
如圖是甲醇(CH3OH)燃料電池工作的示意圖,其中A、B、D均為石墨電極,C為銅電極.工作一段時間后,斷開K,此時A、B兩極上產生的氣體體積相同.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol HClO溶于水電離出NA個H+ | |
| B. | 標準狀況下,11.2L的CCl4中含有0.5 NA個分子 | |
| C. | 足量Fe與1 mol Cl2充分反應,轉移電子數為2NA | |
| D. | 18.0 g重水(D2O)中所含的電子數為10 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol甲基(-CH3)所含的電子總數為9NA | |
| B. | 1mol甲烷最多與2molCl2發生取代反應 | |
| C. | 標準狀況下,2.24L乙醇含有的分子數目為0.1NA | |
| D. | 0.5 mol苯分子中含有C=C雙鍵數為1.5 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com