
分析 (1)證明上述三種金屬的活動性強弱,結合試劑分析,可以利用金屬和稀鹽酸反應劇烈程度和是否反應進行檢驗;
(2)鋁片、銅片、鐵片三種金屬投入濃硫酸中常溫下鐵和鋁在濃硫酸中發生鈍化,銅和濃硫酸加熱才能發生反應;
(3)鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣;
(4)稀硝酸和鋁片、銅片、鐵片都發生反應,銅片和氫氧化鈉、濃硫酸、濃鹽酸不反應;
(5)氧化銅和氫氧化鈉溶液不反應,氧化鋁是兩性氧化物和氫氧化鈉溶液反應.
解答 解:(1)氫氧化鈉溶液、稀硝酸、濃硫酸、濃鹽酸四種溶液中,氫氧化鈉不能和銅鐵反應,稀硝酸和金屬都反應,濃硫酸中鐵、鋁鈍化,銅需要加熱反應,所以用于判斷金屬性強弱的選擇濃鹽酸和金屬反應的反應劇烈程度,與同濃度鹽酸反應劇烈的是鋁,反應程度小的為鐵,不反應的是銅,反應的化學方程式為:Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
故答案為:Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑;
(2)鋁片、銅片、鐵片三種金屬投入濃硫酸中常溫下鐵和鋁在濃硫酸中發生鈍化,銅和濃硫酸加熱才能發生反應,室溫下,將三種金屬分別投入上述某種溶液中,均不能觀察到明顯的現象的溶液是濃硫酸,
故答案為:濃硫酸;
(3)上述某一溶液只能和三種金屬中的一種發生化學反應,其中鋁和氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,反應的離子方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)稀硝酸具有強氧化性和鋁片、銅片、鐵片都發生反應,銅片和氫氧化鈉、濃硫酸、濃鹽酸不反應,室溫下,上述某一溶液能和三種金屬發生反應的溶液為稀硝酸,Cu與稀硝酸反應的離子反應為3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)除去氧化銅粉末中混有的少量氧化鋁粉,可以利用氧化銅和氫氧化鈉溶液不反應,氧化鋁是兩性氧化物和氫氧化鈉溶液反應溶解除去,
故答案為:氫氧化鈉溶液.
點評 本題考查性質實驗方案的設計,為高頻考點,把握物質的性質、發生的反應及實驗技能為解答的關鍵,側重分析與實驗能力的考查,注意實驗設計能力的應用,題目難度不大.


 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:選擇題
| A. | 石墨和C60互為同位素 | |
| B. | CH3CH2OH和CH3OCH3互為同分異構體 | |
| C. | l4CO2的摩爾質量為46 | |
| D. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl為不同的核素,有不同的化學性質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 固態氨,礦泉水,漂粉精 | B. | 液態氧,干冰,水玻璃 | ||
| C. | 稀有氣體,氯化鉀,鐵礦石 | D. | 天然氣,氧化汞,不銹鋼 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
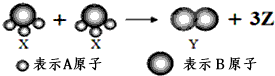
| A. | 該反應屬于分解反應 | |
| B. | 該反應屬于氧化還原反應 | |
| C. | X、Y、Z三種物質均屬于非電解質 | |
| D. | 根據質量守恒定律可推知,1個Z分子含有兩個A原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實現能源的清潔利用,就需開發新能源 | |
| B. | 開發太陽能、水能、風能、可燃冰等新能源,減少使用煤、石油等化石燃料 | |
| C. | 落實資源的“3R”發展觀,即:減少資源消耗(Reduce)、增加資源的重復使用(Reuse) | |
| D. | 更新采煤、采油技術,提高產量以滿足工業生產的快速發展 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
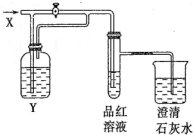 向如圖所示的裝置中緩慢地通入氣體X,若關閉活塞,則品紅溶液無變化而澄清石灰水變渾濁;若打開活塞,則品紅溶液褪色.
向如圖所示的裝置中緩慢地通入氣體X,若關閉活塞,則品紅溶液無變化而澄清石灰水變渾濁;若打開活塞,則品紅溶液褪色.| 選項 | A | B | C | D |
| X | NO2 | SO2 | HCl | Cl2 |
| Y | 水 | 飽和NaHCO3溶液 | Na2SO3溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com