
【題目】某學生用中和滴定法測定某燒堿樣品的純度。先準確稱量10.0g含有少量中性易溶雜質的樣品,配成500mL待測溶液。用0.200mol/L的鹽酸標準液滴定待測液,滴定時用酚酞做指示劑。試根據實驗回答下列問題:
(1)下列有關滴定操作的順序正確的是
①用標準溶液潤洗滴定管 ②往滴定管內注入標準溶液
③檢查滴定管是否漏水 ④滴定 ⑤洗滌
A.⑤①②③④ B.③⑤①②④ C.③⑤②①④ D.②①③⑤④
(2)用標準的鹽酸滴定待測的NaOH溶液時,一手握酸式滴定管的活塞,一手搖動錐形瓶,眼睛注視_________,本實驗滴定達到終點的標志是_________________________。
(3)根據下表數據,計算被測燒堿溶液的物質的量濃度是 ,燒堿樣品的純度是___________
滴定次數 | 待測溶液體積(mL) | 標準酸體積 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
第三次 | 10.00 | 0.20 | 24.20 |
(4)若該實驗修改成“用待測堿液滴定鹽酸標準液”,則下列操作會使燒堿樣品純度偏高的是
A.錐形瓶用蒸餾水洗凈后,先用鹽酸標準液潤洗再裝標準液。
B.堿式滴定管用蒸餾水洗凈后未潤洗
C.滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失
D.滴定前仰視堿式滴定管讀數,滴定后俯視滴定管讀數
【答案】
(1)B
(2)錐形瓶中溶液的顏色變化 溶液顏色由紅色突變成無色,且半分鐘內不恢復原來的顏色。
(3)0.400 80% (4)D
【解析】
試題分析:(1)中和滴定中,按照檢漏、洗滌、潤洗、裝液、滴定等操作進行,則正確的滴定順序為:③⑤①②④,故選B;
(2)酸堿中和滴定時,眼睛要注視錐形瓶內溶液的顏色變化,滴定終點時溶液顏色由紅色突變為無色,且半分鐘內不恢復原來的顏色;
(3)三次消耗的鹽酸的體積為20.10mL,19.90mL,24.00mL,第三次舍去,其他兩次溶液的平均體積為20.00mL,NaOH溶液的體積為10.00mL,
HCl~~~~~~~NaOH
1 1
0.20molL-1×20.00mL C(NaOH)×10.00mL
解得:C(NaOH)=0.40mol/L,
樣品中NaOH的物質的量為0.40mol/L×0.5L=0.2mol,
NaOH的質量為0.2mol×40g/mol=8.0g,樣品純度為8.0g÷10.0g×100%=80%;
(4)A.錐形瓶用蒸餾水洗凈后再用標準液潤洗,不影響標準液的量,測定結果無影響,故A錯誤;B.堿式滴定管未用待測的堿溶液潤洗就直接注入待測溶液,待測溶液的濃度偏小,造成V(待測)偏大,根據c(待測)=![]() 分析,測定c(待測)偏低,故B錯誤;C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失,添加的標準液偏多,,造成V(待測)偏大,根據c(待測)=
分析,測定c(待測)偏低,故B錯誤;C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失,添加的標準液偏多,,造成V(待測)偏大,根據c(待測)=![]() 分析,測定c(待測)偏低,故C錯誤;D.讀取待測堿溶液體積時,開始仰視讀數,滴定結束時俯視讀數,造成V(待測)偏小,c(待測)=
分析,測定c(待測)偏低,故C錯誤;D.讀取待測堿溶液體積時,開始仰視讀數,滴定結束時俯視讀數,造成V(待測)偏小,c(待測)=![]() 分析,測定c(待測)偏高,故D正確;故答案為D。
分析,測定c(待測)偏高,故D正確;故答案為D。


 探究與鞏固河南科學技術出版社系列答案
探究與鞏固河南科學技術出版社系列答案科目:高中化學 來源: 題型:
【題目】CuCl2、CuCl是重要的化工原料,廣泛地用作有機合成催化劑。實驗室中以粗銅(含雜質Fe)為原料,一種制備銅的氯化物的流程如下:

請回答下列問題:
(1)如圖裝置進行反應①,導管a通入氯氣(夾持儀器和加熱裝置省略)。觀察到的現象是______________,
寫出銅與氯氣反應的化學方程式 ______________________。
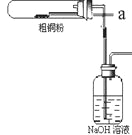
(2)上述流程中固體K溶于稀鹽酸的目的是___________________。試劑X、固體J的物質分別為____________________。
a.NaOH Fe(OH)3 b.NH3·H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反應②是向溶液2中通入一定量的SO2,加熱一段時間后生成CuCl白色沉淀。寫出制備CuCl的離子方程式____________________。
(4)反應后,如圖盛有NaOH溶液的廣口瓶中溶液具有漂白、消毒作用,若用鋼鐵(含Fe、C)制品盛裝該溶液會發生電化學腐蝕,鋼鐵制品表面生成紅褐色沉淀,溶液會失去漂白、殺菌消毒功效。該紅褐色沉淀的主要化學式是_____________。該腐蝕過程的正極反應式為___________________。
(5)以石墨為電極,電解CuCl2溶液時發現陰極上也會有部分CuCl析出,寫出此過程中陰極上的電極反應式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】巧妙的實驗設計有助于更好地解決問題。下列裝置不能達到實驗目的的是
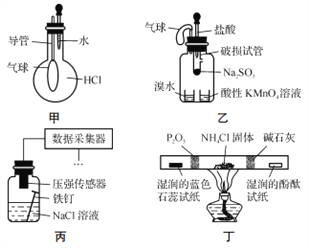
A. 用裝置甲驗證HCl氣體易溶于水
B. 用裝置乙驗證SO2具有漂白性
C. 用裝置丙采集到的壓強數據判斷鐵釘發生析氫腐蝕還是吸氧腐蝕
D. 用裝置丁檢驗NH4Cl分解產生的氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廢液是用稀硝酸腐蝕鋅板后得到的 ,某化學興趣小組擬用該廢液(含有少量的Cl-、Fe3+)制取Zn(NO3)2·6H2O的過程如下:
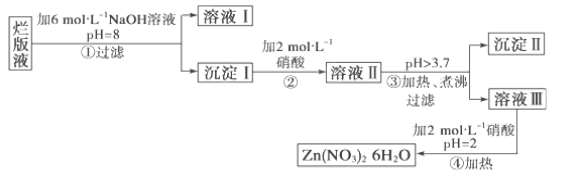
已知:Zn(NO3)2·6H2O是一種無色晶體,水溶液呈酸性,Zn(NO3)2能與堿反應,得到的產物Zn(OH)2具有兩性,Fe3+在PH=3.7時就能完全沉淀。
(1)該廢液溶質的主要成分是________(填化學式)。
(2)在操作①中保持pH=8的目的是______________________。
(3)沉淀Ⅰ的成分是___________________________。
(4)操作③中加熱、煮沸的目的是________________________;
(5)操作④保持pH=2的目的是__________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】糖類、脂肪和蛋白質是維持人體生命活動所必需的三大營養物質。以下敘述正確的是
A.植物油不能使溴的四氯化碳溶液褪色
B.葡萄糖能發生氧化反應和水解反應
C.麥芽糖水解的最終產物是葡萄糖
D.蛋白質溶液遇硫酸銅后產生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
環己酮:無色或淺黃色透明液體,有強烈的刺激性臭味,密度(相對水=1):0.95,熔點:-45℃,沸點:155℃,溶解度(100mL H2O):2.4g(31℃)。
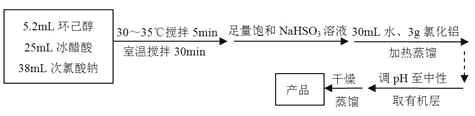
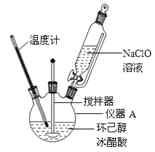
主反應:
回答下列問題:
(1)儀器A的名稱是 。
(2)在反應開始的5min,為了將體系溫度維持在30~35℃,除了用冰水浴冷卻外,采取的措施還有 、 。
(3)加入飽和NaHSO3溶液時發生的主要反應是 (用離子方程式表示),確保加入的飽和NaHSO3溶液已經足量的實驗操作是 。
(4)為將餾出液的pH調至中性,可以加入的試劑是 。
A.稀鹽酸 | B.無水碳酸鈉 | C.濃硫酸 | D.氫氧化鈉固體 |
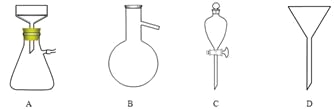
(5)調節pH后還需加入精制食鹽,其目的是 ,“取有機層”時使用的主要儀器是 。(填下圖對應的字母)。
(6)實驗條件的優化對實驗成敗至關重要,小組成員覺得有必要對NaClO溶液的最佳濃度進行探究。他們配制了一系列不同濃度的NaClO溶液,并用滴定法標定。具體方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于錐形瓶中,加入適量稀鹽酸和KI固體(足量),用0.1000mol/L Na2S2O3標準溶液滴定至終點(用淀粉溶液作指示劑),三次平行實驗平均消耗Na2S2O3標準溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。則該NaClO溶液的濃度是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com