
【題目】砷是生命的第七元素,可形成多種重要化合物,如雌黃(As2S3)、雄黃(As4S4)、砷酸(H3AsO4)和亞砷酸(H3AsO3)等。
(1)雄黃可入藥。若0.5mo1雄黃與O2反應生成As2O3,轉移14mol電子,則另一種產物為______________(填化學式)。
(2)砷酸(H3AsO4)是一種重要化工產品,可與足量NaOH溶液反應生成Na3AsO4。NaH2AsO4溶液水解反應的Kh=_________,該溶液顯______(填“酸”或“堿”)性。若向該溶液中加入少量NaOH固體,則溶液中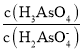 將_______(填“增大”、“減小”或“不變”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
將_______(填“增大”、“減小”或“不變”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
(3)亞砷酸(H3AsO3)可以用于治療白血病,其在溶液中存在多種微粒形態。常溫下,用NaOH溶液滴定H3AsO3時,各種微粒的物質的量分數隨pH的變化如圖所示。
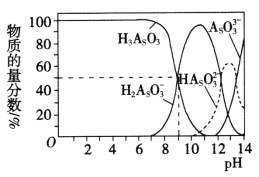
以酚酞為指示劑,將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為紅色時停止滴加。該過程中主要反應的離子方程式為_______________,pH=8時,溶液中,c(Na+)________c(H2AsO3-)(填“>”、“<”或“=”)。
【答案】SO2 2×10-12 酸 減小 H3AsO3+OH-==H2AsO3+H2O >
【解析】
(1)利用氧化還原反應中得失電子相等進行分析。
(2)水解常數與電力平衡常數相乘等于離子積常數,根據第二步電離常數和水解常數比較得出酸堿性,溶液中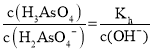 ,分析氫氧根濃度得出答案。
,分析氫氧根濃度得出答案。
(3)即pH為8.2時主要是H3AsO3和H2AsO3-,得出離子方程式,pH=8時,溶液為NaH2AsO3和H3AsO3,溶液顯堿性,水解大于電離,因此得出關系。
(1)雄黃可入藥。若0.5mo1雄黃與O2反應生成As2O3,轉移14mol電子,即1mol雄黃與O2反應生成As2O3,轉移28mol電子,硫為-2價,則As為+2價,轉移了4mol電子,則4mol硫總共轉移24mol電子,即1個硫升高6加,變為+4價的硫,則另一種產物為SO2,即答案為:SO2。
(2)砷酸(H3AsO4)是一種重要化工產品,可與足量NaOH溶液反應生成Na3AsO4。NaH2AsO4溶液水解反應的![]() ,Ka2大于Kh,因此該溶液顯酸性;若向該溶液中加入少量NaOH固體,則溶液中
,Ka2大于Kh,因此該溶液顯酸性;若向該溶液中加入少量NaOH固體,則溶液中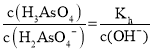 ,氫氧根濃度增大,因此比值減小;故答案為:2×10-12;酸;減小。
,氫氧根濃度增大,因此比值減小;故答案為:2×10-12;酸;減小。
(3)以酚酞為指示劑,將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為紅色時停止滴加,即pH為8.2時主要是H3AsO3和H2AsO3-,該過程中主要反應的離子方程式為H3AsO3+OH- = H2AsO3-+H2O,pH=8時,溶液為NaH2AsO3和H3AsO3,溶液顯堿性,水解大于電離,因此溶液中c(Na+) > c(H2AsO3-),故答案為:H3AsO3+OH- = H2AsO3-+H2O;>。


科目:高中化學 來源: 題型:
【題目】水楊酸冬青油、阿司匹林的結構簡式如圖,下列說法不正確的是

A. 由水楊酸制冬青油的反應是取代反應
B. 阿司匹林的分子式為C9H8O4,在一定條件下水解可得水楊酸
C. 冬青油苯環上的一氯取代物有4種
D. 可用NaOH溶液除去冬青油中少量的水楊酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在密閉容器中發生可逆反應的平衡常數K=![]() 。當反應達到平衡時,n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以2∶2∶1的物質的量之比再充入A、B、C,則
。當反應達到平衡時,n(A)∶n(B)∶n(C)=2∶2∶1。若保持溫度不變,以2∶2∶1的物質的量之比再充入A、B、C,則
A.K值增大B.達到新平衡后,C的體積分數增大
C.平衡不移動D.達到新平衡后,vA比原平衡減慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃料電池是目前電池研究的熱點之一。某課外小組自制的氫氧燃料電池如圖所示,a、b均為惰性電極下列敘述不正確的是( )
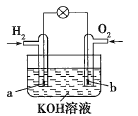
A.a極是負極,該電極上發生氧化反應
B.b極發生的電極反應是O2+4OH--4e-=2H2O
C.電池總反應方程式為2H2+O2=2H2O
D.氫氧燃料電池是一種具有應用前景的綠色電源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NA是阿伏加德羅常數的值,下列說法錯誤的是
A. 3g 3He含有的中子數為1NA
B. 1 L 0.1 mol·L1磷酸鈉溶液含有的![]() 數目為0.1NA
數目為0.1NA
C. 1 mol K2Cr2O7被還原為Cr3+轉移的電子數為6NA
D. 48 g正丁烷和10 g異丁烷的混合物中共價鍵數目為13NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美國勞倫斯·利弗摩爾國家實驗室(LLNL)設計的以熔融的碳酸鹽為電解液,泡沫鎳為電極,氧化纖維布為隔膜的直接碳燃料電池結構如圖所示,下列說法錯誤的是( )
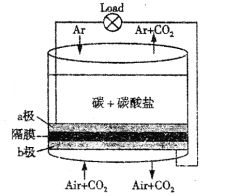
A. a極通氣的目的是增強導電能力
B. a極的電極反應式為C+2CO32--4e-=3CO2↑
C. 電流由b極沿導線經負載再流向a極
D. CO32-由b極區透過隔膜流向a極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分別滴加0.1 mol·L-lAgNO3溶液。滴加過程中pM[-lgc(Cl-)或-lgc(CrO42-)]與所加AgNO3溶液體積之間的關系如下圖所示。已知Ag2CrO4為紅棕色沉淀。下列說法錯誤的是
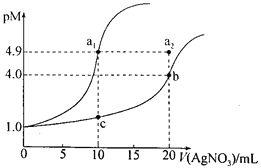
A. 該溫度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三點所示溶液中c(Ag+):al>b>c
C. 若將上述NaCl溶液濃度改為0.2mol·L-1,則a1點會平移至a2點
D. 用AgNO3標準溶液滴定NaCl溶液時,可用K2CrO4溶液作指示劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:![]() 時,
時,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 。
。
![]() 溶液和NaHA溶液反應的主要離子方程式為________________________________
溶液和NaHA溶液反應的主要離子方程式為________________________________![]() 不考慮
不考慮![]() 與
與![]() 發生氧化還原反應
發生氧化還原反應![]() 。
。
![]() 溶液中離子濃度由大到小的順序為 ____________________________。
溶液中離子濃度由大到小的順序為 ____________________________。
![]() 時,將
時,將![]() 的HCOOH溶液和
的HCOOH溶液和![]() 的
的![]() 溶液分別與
溶液分別與![]() 的
的![]() 溶液混合,實驗測得產生的氣體體積
溶液混合,實驗測得產生的氣體體積![]() 隨時間
隨時間![]() 變化的示意圖如圖所示:
變化的示意圖如圖所示:
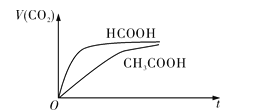
![]() 的電離平衡常數表達式
的電離平衡常數表達式![]() __________________________。
__________________________。
![]() 反應初始階段,兩種溶液產生
反應初始階段,兩種溶液產生![]() 氣體的速率存在明顯差異的原因是__________________________________________________________________________________,反應結束后所得兩溶液中,
氣體的速率存在明顯差異的原因是__________________________________________________________________________________,反應結束后所得兩溶液中,![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 時,某溶液中含有
時,某溶液中含有![]() 、
、![]() 加入KOH固體以調節溶液
加入KOH固體以調節溶液![]() 忽略溶液體積的變化、忽略
忽略溶液體積的變化、忽略 ![]() 的揮發和分解
的揮發和分解![]() 。當pH為7時,能否有
。當pH為7時,能否有![]() 沉淀生成?________
沉淀生成?________![]() 填“能”或“否”
填“能”或“否”![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】麥考酚酸是一種有效的免疫抑制劑,能有效地防止腎移植排斥,其結構簡式如下圖所示。下列有關麥考酚酸說法正確的是( )

A. 分子式為C17H23O6
B. 不能與FeCl3溶液發生顯色反應
C. 在一定條件下可發生加成、取代、消去反應
D. 1 mol麥考酚酸最多能與3 mol NaOH反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com