
【題目】開發、使用清潔能源發展“低碳經濟”,正成為科學家研究的主要課題。氫氣、甲醇是優質的清潔燃料,可制作燃料電池。
(1)己知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) △H2=-566.0 kJ·mol-1
H2O(g)=H2O(l) △H3=-44.0 kJ·mol-1
寫出甲醇燃燒熱的熱化學方程式:___________________________________________________
(2)生產甲醇的原料CO和H2來源于:CH4(g)+H2O(g)![]() CO(g) +3H2(g)
CO(g) +3H2(g)
①一定條件下CH4的平衡轉化率與溫度、壓強的關系如圖a。則p1__________p2(填“<”、“>”、“=”)
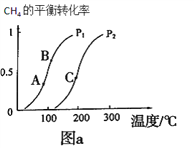
②A、B、C三點處對應平衡常數(KA、KB、KC) 的由大到小順序為_______________。
③100℃時,將1molCH4和2molH2O通入容積為100L的反應室,反應達平衡的標志是:__________。
A.容器內氣體密度恒定 B.單位時間內消耗0.1mol CH4同時生成0.3molH2
C.容器的壓強恒定 D.3v正(CH4)=v逆(H2)
(3)某實驗小組利用CH3OH (g)、O2 (g)、KOH (aq) 設計成燃料電池,負極的電極反應式為:_____________________________,該電池工作時,溶液的pH將__________(填“增大”“減小”“不變”)
【答案】 2CH3OH(l)+3O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1 < KC>KB>KA CD CH3OH-6e-+8OH-=CO32-+6H2O 減小
【解析】(1). 已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1275.6kJ·mol-1,②H2O(g)=H2O(l)△H3=-44.0kJ·mol-1,根據蓋斯定律,(①+②×4)÷2得表示甲醇燃燒熱的熱化學方程式為:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,故答案為:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,故答案為:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1;
(2). ①. CH4(g)+H2O(g)![]() CO(g)+3H2(g)為氣體增多的可逆反應,增大壓強,平衡逆向移動,CH4的轉化率減小,由圖a可知,相同溫度下,壓強為p1時的轉化率大于p2時的轉化率,則p1<p2,故答案為:<;
CO(g)+3H2(g)為氣體增多的可逆反應,增大壓強,平衡逆向移動,CH4的轉化率減小,由圖a可知,相同溫度下,壓強為p1時的轉化率大于p2時的轉化率,則p1<p2,故答案為:<;
②. 由圖a可知,升高溫度,CH4的轉化率增大,說明CH4(g)+H2O(g)![]() CO(g)+3H2(g)的正反應為吸熱反應,升高溫度平衡正向移動,平衡常數增大,因溫度TA<TB<TC,則平衡常數KC>KB>KA,故答案為:KC>KB>KA;
CO(g)+3H2(g)的正反應為吸熱反應,升高溫度平衡正向移動,平衡常數增大,因溫度TA<TB<TC,則平衡常數KC>KB>KA,故答案為:KC>KB>KA;
③. A.在恒溫恒容的條件下發生反應CH4(g)+H2O(g)![]() CO(g)+3H2(g),容器內氣體的密度始終不變,則容器內氣體密度恒定,不能說明反應達到平衡狀態,故A錯誤;B.單位時間內消耗0.1mol CH4的同時生成0.3molH2,表示的均為正反應速率,不能說明正反應速率和逆反應速率相等,不一定為平衡狀態,故B錯誤;C.該反應為反應前后氣體物質的量不相等的可逆反應,容器的壓強恒定,說明反應達到平衡狀態,故C正確;D. 當3v正(CH4)=v逆(H2)時,正反應速率等于逆反應速率,反應達到平衡狀態,故D正確;答案為:CD;
CO(g)+3H2(g),容器內氣體的密度始終不變,則容器內氣體密度恒定,不能說明反應達到平衡狀態,故A錯誤;B.單位時間內消耗0.1mol CH4的同時生成0.3molH2,表示的均為正反應速率,不能說明正反應速率和逆反應速率相等,不一定為平衡狀態,故B錯誤;C.該反應為反應前后氣體物質的量不相等的可逆反應,容器的壓強恒定,說明反應達到平衡狀態,故C正確;D. 當3v正(CH4)=v逆(H2)時,正反應速率等于逆反應速率,反應達到平衡狀態,故D正確;答案為:CD;
(3). 利用CH3OH(g)、O2(g)、KOH(aq)設計成燃料電池,在負極上,甲醇失電子發生氧化反應,電極反應式為CH3OH-6e+8OH=CO32+6H2O,該電池的總反應式為2CH3OH+4OH+3O2=2CO32+6H2O,由總反應式可知,溶液中c(OH)減小,溶液的pH將減小,故答案為:CH3OH-6e+8OH=CO32+6H2O;減小。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W、Q在元素周期表中的相對位置如圖所示。下列說法正確的是( )

A. 元素X與元素Z的最高正化合價之和的數值等于8
B. 原子半徑的大小順序為:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 離子Y2-和Z3+的核外電子數和電子層數都不相同
D. 元素W的最高價氧化物對應的水化物的酸性比Q的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)有一種可充電電池Na-Al/FeS,電池工作時Na+的物質的量保持不變,并且是用含Na+的導電固體作為電解質,已知該電池正極反應式為2Na++FeS+2e-=Na2S+Fe,則該電池在充電時,陽極的電極反應式_________________放電時負極反應的物質是__________________。
(2)如圖所示,左室容積為右室的兩倍,溫度相同,現分別按照如圖所示的量充入氣體,同時加入少量固體催化劑使兩室內氣體充分反應達到平衡,打開活塞,繼續反應再次達到平衡,下列說法正確的是__________
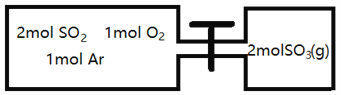
A.第一次平衡時,SO2的物質的量右室更多
B.第一次平衡時,左室內壓強一定小于石室
C.第二次平衡時,SO3的物質的量分數比第一次平衡時右室的SO3的物質的量分數大
D.第二次平衡時,SO2的總物質的量比第一次平衡時左室SO2物質的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等體積的1. 0×10-4mol/LK2CrO4溶液,則溶液中c(CrO42-)=__________
(4)室溫下,0.1mol/LNaHCO3溶液的pH值__________0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室溫下,在0.5mol/LNa2SO3溶液中加入少量水,由水電離出的c(H+) ×c(OH-)__________。(填“變大”、“變小”、“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
硼和氮的單質及一些化合物在工農業生產等領域有重要應用。回答下列問題:
(1)N原子核外有__________種不同運動狀態的電子。基態N原子中,能量最高的電子所占據的原子軌道的電子排布式為:__________
(2)經測定發現N2O5固體由NO2+和NO3-兩種離子組成,該固體中N 原子雜化類型分別為__________;與NO2+互為等電子體的微粒有_______________ (寫出一種)。
(3)銨鹽大多不穩定。NH4F、NH4I中,較易分解的是___________,原因是_____________________
(4)第二周期中,第一電離能介于B元素和N元素間的元素有__________種。
(5)氮化鎵是第三代半導體材料,其晶體結構和單晶硅相似,晶胞結構如圖所示:
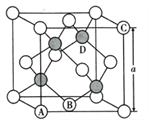
①原子坐標參數是表示晶胞內部各原子的相對位置,其中原子坐標參數A為(0,0,0 );B為(1/2,1/2,0) ;C為(1,0,1)。則D原子的坐標參數為____________________。
②己知氮化鎵晶胞的邊長為anm,其密度為dg/cm3。則阿伏伽德羅常數NA=__________( 用a、d表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E 五種短周期元素(A、B、C、D、E 分別代表元素符號),它們的原子序數依次增大; A 是元素周期表中原子半徑最小的元素;B 元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽 X;D 與 A 同主族,且與 E 同周期;E 元素原子的最外層電子數是其次外層電子數的 3/4 倍;C 與 E 同 主族。請回答下列問題:
(1)X 的化學式_____。
(2)下列各項中,能說明元素 C 比 E 非金屬性強的事實有_____(填序號).
① 氫化物H2E的酸性比H2C強
② 氫化物H2C的熱穩定性比H2E強
③ 氫化物H2E的水溶液放置在空氣中會變渾濁
④ C 與 E 組成化合物,C 顯負價
(3)將由 BC 和BC2組成的混合氣體通入如圖所示裝置中,用來驗證濃硝酸的氧化性比稀硝酸的氧化性強。

已知(i)濃硝酸能將氣體 BC 氧化成BC2,而稀硝酸不能氧化 BC。
(ii)NaOH 溶液與BC2反應的化學方程式為:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液與 BC 氣體不反應。 裝置②、③中盛放的藥品依次是_______、______________.
(4)通入混合氣體之前,應先通入一段時間某另外一種氣體,試推測先通入的該氣體可以是__________(填 一種氣體的化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學氣敏傳感器可用于監測環境中NH3的含量,其工作原理示意圖如下。下列說法不正確的是( )

A. O2在電極b上發生還原反應
B. 溶液中OH-向電極a移動
C. 反應消耗的NH3與O2的物質的量之比為4∶5
D. 負極的電極反應式為2NH3-6e-+6OH-===N2+6H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com