
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |



科目:高中化學 來源: 題型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Pb(OH)2 | Mn(OH)2 | PbS | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 8.7 | 10.4 | ≥0.1 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Mn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化學 來源: 題型:
(07年廣東化學·24)(10分)

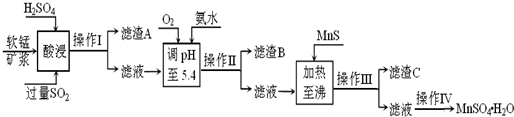
二氧化錳是制造鋅錳干電池的基本材料。工業上以軟錳礦為原料,利用硫酸亞鐵制備高純二氧化錳的流程如下:
某軟錳礦的主要成分為MnO2,還含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分陽離子以氫氧化物或硫化物的形式完全沉淀時溶液的pH見下表,回答下列問題:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亞鐵在酸性條件下將MnO2還原為MnSO4,酸浸時發生的主要反應的化學方程式為 。
(2)濾渣A的主要成分是 。
(3)加入MnS的目的是除去 雜質。
(4)堿性鋅錳電池中,MnO2參與的電極反應方程式為 。
(5)從廢舊堿性鋅錳電池中可以回收利用的物質有 (寫出兩種)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com