
鈦有強度高和質地輕的優點,廣泛應用于飛機制造業等。工業上利用鈦鐵礦,其主要成分為鈦酸亞鐵(FeTiO3)制備鈦金屬,工業流程如下: 已知:Ti與TiO2化學性質穩定,不溶于稀硫酸、稀鹽酸等。
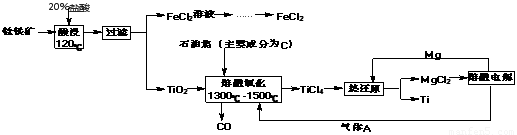
(1)請寫出FeTiO3與稀鹽酸反應的離子方程式:?????????????????????????????? ????? ????? 。
(2)請寫出“熔融氧化”的化學方程式:???????????????????????????????????????? ?????? ???? 。
(3)電解氯化鎂的陰極反應式為:???????????????????????????????????????????????? ,可循環利用的物質為:?????????????????????????????? (填化學式)。
(4)熱還原法中能否改用鈉代替鎂作還原劑:???? (填“能”或“不能”);原因為:?????? ????????????????????????????????????? ? ?????????????????? 。
(5)用此方法制備得到的Ti金屬常混有MgCl2和Mg,除雜試劑是????????? (填化學式)。
(1)FeTiO3+2H+ 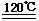 Fe2++TiO2+H2O?? (3分)
Fe2++TiO2+H2O?? (3分)
(2)TiO2+ 2C+ 2Cl2 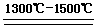 TiCl4+ 2CO? (3分)
TiCl4+ 2CO? (3分)
(3)Mg2+ + 2e- = Mg (3分)?? Cl2和Mg? (2分)
(4)能;(1分)鈉的還原性比鎂強(1分)
(5)HCl(2分)(填寫H2SO4、HNO3均可)
【解析】
試題分析:由已知條件可知,金屬Ti是難溶于稀硫酸和稀鹽酸的物質,而雜質MgCl2和Mg都是易溶于酸的,所以要除去雜質,可以加入稀鹽酸或稀硫酸等試劑。
(1)根據流程圖示,鈦鐵礦中加入鹽酸酸浸后,得到了濾液氯化亞鐵和濾渣TiO2,所以根據反應物和產物可以寫出反應的離子方程式為:FeTiO3+2H+ 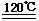 Fe2++TiO2+H2O。
Fe2++TiO2+H2O。
(2)熔融氧化過程中參與反應的物質已知的有TiO2和C,從產物來看C作了還原劑被氧化成了CO,但是TiO2生成TiCl4,Ti的化合價沒有發生變化,且多出了Cl離子,所以由此可以猜測還有一種氧化劑參與了反應,而氧化劑就是氯氣,所以根據所推反應物和生成物,該反應的化學方程式為:TiO2+ 2C+ 2Cl2 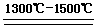 TiCl4+ 2CO。
TiCl4+ 2CO。
(3)電解氯化鎂可以制備金屬鎂,所以陰極發生的反應式為Mg2+ + 2e- = Mg,而陽極發生氧化反應生成氯氣,電解產生的金屬鎂、氯氣可以分別在熱還原步驟和熔融氧化步驟中加以循環利用。
(4)熱還原是在高溫的條件下用活潑金屬還原制備較不活潑金屬的過程,金屬鈉比金屬鎂更加活潑,所以也可以用金屬鈉代替金屬鎂做還原劑。
考點:本題考查的是比較基礎的化學工藝流程題。


湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com