
【題目】某校研究性學習小組的同學進行了以下化學實驗:將金屬鈣置于空氣中燃燒,然后向所得固體產物中加入一定量蒸餾水,此過程中反應放出大量的熱,并且放出有臭味的氣體。
(1)甲同學提出:運用類比學習的思想,Ca與Mg位于同一主族,化學性質具有一定的相似性。請寫出Ca在空氣中燃燒發生反應的化學方程式___________________。
(2)乙同學提出:Ca的性質比Na活潑,在空氣中燃燒還應有CaO2生成,請寫出燃燒后固體產物與水反應放出氣體的化學方程式____________________。
(3)丙同學提出用實驗的方法探究放出臭味氣體的成分:
(查閱資料)
1.CaO2遇水反應生成H2O2,H2O2可能會分解產生一定量的O3。
2.碘量法是最常用的臭氧測定方法,其原理為強氧化劑臭氧(O3)與碘化鉀(KI)水溶液反應生成游離碘(I2),臭氧轉化為氧氣。反應式為O3+2KI+H2O=O2+I2+2KOH。
(提出假設)
假設1:該臭味氣體只有NH3;
假設2:該臭味氣體只有________;
假設3:該臭味氣體含有________。
(設計方案 進行實驗探究)
(4)該小組同學設計如下實驗方案,并進行實驗,驗證上述假設。請完成相關的實驗操作步驟、預期現象及結論(儀器自選)。
限選實驗試劑:紅色石蕊試紙、藍色石蕊試紙、pH試紙、淀粉-KI溶液、蒸餾水。
實驗操作 | 預期現象與結論 |
取少量反應后固體于試管中,______ | _____________ |
【答案】2Ca+O2![]() 2CaO、3Ca+N2
2CaO、3Ca+N2![]() Ca3N2、2Ca+CO2
Ca3N2、2Ca+CO2![]() 2CaO+C 2CaO2+2H2O=2Ca(OH)2+O2↑、Ca3N2+6H2O=3Ca(OH)2+2NH3↑ O3 O3和NH3 向試管中加入少量水,將濕潤的紅色石蕊試紙置于試管口;另取少量反應后固體于試管中,向試管中加入少量水,將產生的氣體通入淀粉-KI溶液中 若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液不變色,則假設1成立;若濕潤的紅色石蕊試紙不顯藍色,且淀粉-KI溶液變藍色,則假設2成立;若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液變藍色,則假設3成立
2CaO+C 2CaO2+2H2O=2Ca(OH)2+O2↑、Ca3N2+6H2O=3Ca(OH)2+2NH3↑ O3 O3和NH3 向試管中加入少量水,將濕潤的紅色石蕊試紙置于試管口;另取少量反應后固體于試管中,向試管中加入少量水,將產生的氣體通入淀粉-KI溶液中 若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液不變色,則假設1成立;若濕潤的紅色石蕊試紙不顯藍色,且淀粉-KI溶液變藍色,則假設2成立;若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液變藍色,則假設3成立
【解析】
(1)由于鎂可以和空氣中的氧氣、二氧化碳、氮氣反應,則鈣也可以和空氣中的氧氣、二氧化碳、氮氣反應;
(2)Ca在空氣中燃燒的產物中能與水反應放出氣體的物質為CaO2和Ca3N2;
(3)根據題中所給信息知,有氣味的氣體可以是NH3,也可以是O3,還可以是二者的混合物;驗證是否含有NH3,可用濕潤的紅色石蕊試紙,若試紙變藍,則證明有NH3;驗證是否含有臭氧,可用淀粉KI溶液,由題給信息知臭氧能使淀粉KI溶液變藍。
(1)由于鎂可以和空氣中的氧氣、二氧化碳、氮氣反應,鈣與鎂的化學性質具有一定的相似性,所以鈣也可以和這三種氣體發生反應,反應的化學方程式為2Ca+O2![]() 2CaO、3Ca+N2
2CaO、3Ca+N2![]() Ca3N2、2Ca+CO2
Ca3N2、2Ca+CO2![]() 2CaO+C,故答案為:2Ca+O2
2CaO+C,故答案為:2Ca+O2![]() 2CaO、3Ca+N2
2CaO、3Ca+N2![]() Ca3N2、2Ca+CO2
Ca3N2、2Ca+CO2![]() 2CaO+C;
2CaO+C;
(2)Ca在空氣中燃燒的產物中能與水反應放出氣體的物質為CaO2和Ca3N2,CaO2與水反應生成氫氧化鈣和氧氣,反應的化學方程式為2CaO2+2H2O=2Ca(OH)2+ O2↑,Ca3N2與水反應生成氫氧化鈣和氨氣,反應的化學方程式為Ca3N2+6H2O=3Ca(OH)2+2NH3↑,故答案為:2CaO2+2H2O=2Ca(OH)2+O2↑、Ca3N2+6H2O=3Ca(OH)2+2NH3↑;
(3)根據題中所給信息知,有氣味的氣體可以是NH3,也可以是O3,還可以是二者的混合物;驗證是否含有NH3,可用濕潤的紅色石蕊試紙,若試紙變藍,則證明有NH3;驗證是否含有臭氧,可用淀粉KI溶液,由題給信息知臭氧能使淀粉KI溶液變藍;具體實驗操作為向試管中加入少量水,將濕潤的紅色石蕊試紙置于試管口;另取少量反應后固體于試管中,向試管中加入少量水,將產生的氣體通入淀粉KI溶液中;預期實驗現象與結論是若濕潤的紅色石蕊試紙顯藍色,且淀粉KI溶液不變色,則假設1成立;若濕潤的紅色石蕊試紙不顯藍色,且淀粉KI溶液變藍色,則假設2成立;若濕潤的紅色石蕊試紙顯藍色,且淀粉KI溶液變藍色,則假設3成立,故答案為:O3;O3和NH3;向試管中加入少量水,將濕潤的紅色石蕊試紙置于試管口;另取少量反應后固體于試管中,向試管中加入少量水,將產生的氣體通入淀粉-KI溶液中;若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液不變色,則假設1成立;若濕潤的紅色石蕊試紙不顯藍色,且淀粉-KI溶液變藍色,則假設2成立;若濕潤的紅色石蕊試紙顯藍色,且淀粉-KI溶液變藍色,則假設3成立。


科目:高中化學 來源: 題型:
【題目】1871年門捷列夫最早預言了類硅元素鍺,鍺元素在元素周期表中與硅元素同族,并位于硅的下一周期。1886年德國化學家溫克勒發現和分離了鍺元素,并以其祖國的名字命名為“Ge”。鍺是重要的的半導體材料,其有機化合物在治療癌癥方面有著獨特的功效。
已知:①丹寧是一種有機沉淀劑,可與四價鍺絡合形成沉淀:
②GeCl4易水解,在濃鹽酸中溶解度低。
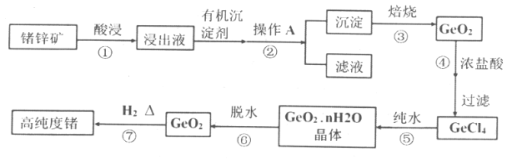
(1)鍺元素的原子序數為:___________;鍺元素在元素周期表中的位置是:_____________。
(2)GeCl4的結構與SiCl4相似,寫出GeCl4的電子式:_______________。
(3)簡述步驟①中提高酸浸效率的措施____________、_____________(寫兩種)。
(4)步驟②操作A是___________(填操作名稱)。
(5)步驟③中的物質在___________(填儀器名稱)中加熱。
(6)步驟④不選用稀鹽酸,而選用濃鹽酸的原因可能是__________、________(寫出兩點)。
(7)寫出步驟⑤的化學方程式________________。
寫出步驟⑦的化學方程式________________。
(8)請寫出一種證明步驟⑦反應完全的操作方法__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,金屬—空氣電池的研究和應用取得很大進步,這種新型燃料電池具有比能量高、污染小、應用場合多等多方面優點。鋁—空氣電池工作原理如圖所示。關于金屬—空氣電池的說法不正確的是( )

A.鋁—空氣電池(如上圖)中,鋁作負極,電子通過外電路到正極
B.為幫助電子與空氣中的氧氣反應,可使用活性炭作正極材料
C.堿性溶液中,負極反應為Al(s)+3OH-(aq)=Al(OH)3(s)+3e-,每消耗2.7 g Al(s),需耗氧6.72 L(標準狀況)
D.金屬—空氣電池的可持續應用要求是一方面在工作狀態下要有足夠的氧氣供應,另一方面在非工作狀態下能夠密封防止金屬自腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,在4L密閉容器中,某反應中的氣體M和氣體N的物質的量隨時間變化的曲線如圖所示:

(1)t1時刻N的轉化率為____________。
(2)0~t3時間內用M表示的化學反應速率為____________mol/(L·min)。
(3)平衡時容器內氣體的壓強與起始時容器內壓強的比值為____________。
(4)該反應的化學方程式為____________;比較t2時刻,正逆反應速率大小:v正____v逆(填“>”、“=”或“<”)。
(5)其他條件不變時,采取下列措施,反應速率的變化情況如何?保持恒溫、恒容:①充入少量氦氣:____________(填“增大”、“減小”或“不變”,下同);
②充入一定量的氣體N:____________。
(6)下列能表示上述反應達到化學平衡狀態的是____________。(填編號)
A.v逆(M)=2v正(N) B.M與N的物質的量之比保持不變
C.混合氣體密度保持不變 D.容器中壓強保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2的結構可以表示為![]() ,CO的結構可以表示為
,CO的結構可以表示為![]() ,其中橢圓框表示π鍵,下列說法不正確的是( )
,其中橢圓框表示π鍵,下列說法不正確的是( )
A. N2分子與CO分子中都含有三鍵
B. N2分子與CO分子中π鍵并不完全相同
C. N2分子與CO分子互為等電子體
D. N2分子與CO分子的化學性質相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙二酸俗名草酸,下面是化學學習小組的同學對草酸晶體(H2C2O4·xH2O)進行的探究性學習的過程。
請你參與并協助他們完成相關學習任務.
該組同學的研究課題是:探究測定草酸晶體(H2C2O4xH2O)中的x值.通過查閱資料和網絡查尋得,草酸易溶于水,水溶液可以用酸性KMnO4溶液進行滴定.學習小組的同學設計了滴定的方法測定x值.
①稱取2.520g純草酸晶體,將其制成100.00mL水溶液為待測液.
②取25.00mL待測液放入錐形瓶中,再加入適量的稀H2SO4.
③用濃度為0.1000molL-1的KMnO4標準溶液進行滴定,達到終點時消耗20.00mL.
(1)滴定時,將酸性KMnO4標準液裝在如圖中的_______(填“甲”或“乙”)滴定管中。

(2)本實驗滴定達到終點的標志是________________;
(3)通過上述數據,求得x=______;
討論:①若滴定終點時仰視滴定管刻度,則由此測得的x值會______(填“偏大”、“偏小”或“不變”,下同);
②若滴定時所用的酸性KMnO4溶液因久置而導致濃度變小,則由此測得的x值會__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備純硅反應的熱化學方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某溫度、壓強下,將一定量的反應物通入密閉容器中進行以上的反應(此條件下為可逆反應),下列敘述正確的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某溫度、壓強下,將一定量的反應物通入密閉容器中進行以上的反應(此條件下為可逆反應),下列敘述正確的是
A. 反應過程中,若增大壓強能提高SiCl4的轉化率
B. 若反應開始時SiCl4為1mol,則達到平衡時,吸收熱量為QkJ
C. 反應至4min時,若HCl的濃度為0.12mol·L-1,則H2的反應速率為0.03mol/(L·min
D. 當反應吸熱為0.025QkJ時,生成的HCl與100mL1mol·L-1的NaOH溶液恰好反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅-空氣燃料電池可用作電動車動力電源,電池的電解質溶液為![]() 溶液,反應為
溶液,反應為![]() 。下列說法正確的是( )
。下列說法正確的是( )
A.充電時,電解質溶液中![]() 向陽極移動
向陽極移動
B.充電時,電解質溶液中![]() 逐漸減小
逐漸減小
C.放電時,負極反應為:![]()
D.放電時,電路中通過![]() 電子,消耗氧氣
電子,消耗氧氣![]() (標準狀況)
(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關反應限度的說法錯誤的是
A.可逆反應達到反應限度之前,正反應速率與逆反應速率一定不相等,但各物質的濃度可能相等
B.可逆反應的化學反應限度不會隨反應條件的改變而改變
C.化學反應的限度決定了反應物在該條件下的最大轉化率
D.一定條件下,煉鐵高爐尾氣中CO含量不隨高爐高度改變而改變,是因為有關反應達到了限度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com