
【題目】下列變化需要加入氧化劑的是( )
A.S2﹣→HS﹣
B.HCO3﹣→CO2
C.2Cl﹣→Cl2
D.Cu2+→Cu
科目:高中化學 來源: 題型:
【題目】欲除去下列物質中混入的少量雜質(括號內為雜質),所選試劑和分離方法都正確的是( )
A.CH4(Cl2):飽和食鹽水洗氣
B.C2H4(SO2):NaOH溶液洗氣
C.溴苯(Br2):NaOH溶液蒸餾
D.FeCl3溶液(CuCl2):鐵粉過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式中正確的是( )
A.稀硫酸滴在銅片上:Cu+2H+═Cu2++H2↑
B.硫酸鈉與氯化鋇溶液混和:SO42﹣+Ba2+═BaSO4↓
C.硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3
D.氧化銅與硫酸混和:Cu2++SO42﹣═CuSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下表為 25℃時某些弱酸的電離平衡常數,依據所給信息判斷,下列說法正確的是( )
| HClO |
|
|
|
|
A. 向NaClO溶液中通入少量二氧化碳的離子方程式為:2ClO— + CO2 + H2O═2HClO + CO32—
B. 相同濃度的CH3COONa和NaClO的混合溶液中,c(CH3COOH) + c(HClO) ═ c(OH—) – c(H+)
C. 25℃時,0.1mol/LCH3COONa溶液中通入CO2至溶液的PH=7時,溶液中:c(Na+) ═ c(CO32—) + c(HCO3—) + c(H2CO3)
D. 向0.1mol/LCH3COONa溶液中加入少量水,溶液中 c(CH3COO—)/c(CH3COOH).c(OH—)增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究硫元素及其化合物的性質具有重要意義。
(1)①硫離子的結構示意圖為 。
②加熱時,硫元素的最高價氧化物對應水化物的濃溶液與木炭反應的化學方程式為 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl氣體或加入NaOH固體以調節溶液pH,溶液pH與c(S2-)關系如圖(忽略溶液體積的變化、H2S的揮發)。

①pH=13時,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,當溶液pH= 時,Mn2+開始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,兩種酸的電離平衡常數如下表。

①HSO3-的電離平衡常數表達式K= 。
②0.10 mol·L-1Na2SO3溶液中離子濃度由大到小的順序為 。
③H2SO3溶液和NaHCO3溶液反應的主要離子方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關熱化學方程式書寫與對應表述均正確的是
A. 稀硫酸與0.1 mol/L NaOH溶液反應:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 則可知C的燃燒熱為110.5 kJ·mol1
C. 密閉容器中,0.3mol硫粉與0.2mol鐵粉混合加熱生成硫化亞鐵0.2mol時,放出19.12 kJ熱量。則Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g) + 3H2(g) ![]() 2NH3(g) △H= —38.6kJ·mol1
2NH3(g) △H= —38.6kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國藥學家屠呦呦因發現植物黃花蒿葉中含貧抗瘧疾的物質——青蒿素而榮獲2015年諾貝爾獎。科學家對青蒿素的結構進行進一步改良,合成藥效更佳的雙氫青蒿素、蒿甲醚。

下列說法錯誤的是
A. 利用黃花蒿葉研究青蒿素結構的基本步驟為:分離、提純→元素分析確定實驗式→測定相對分子質量確定分子式→波譜分析確定結構式
B. ①、②的反應類型分別為還原反應、取代反應
C. 可用質譜法確定分子中含有何種官能團的信息
D. 雙氫青蒿素在水中的溶解性大于青蒿素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 目前加碘食鹽中主要添加的是KIO3
B. 日常生活中和醫院常用無水乙醇殺菌消毒
C. 綠色食品是指不含任何化學物質的食品
D. 在空氣質量日報中CO2含量屬于空氣污染指數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、硫和釩的相關化合物,在藥物化學及催化化學等領域應用廣泛。回答下列問題:
(1)基態釩的原子結構示意圖為____________________________;
(2)VO43-的中心原子價層孤電子對數目為______,一個VO43-離子中含有_______個σ鍵;
(3)2-巰基煙酸氧釩配合物(圖1) 是副作用小的有效調節血糖的新型藥物。
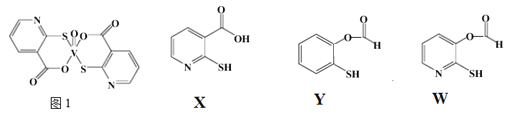
①該藥物中N原子的雜化方式是_______;
②X、Y、W三種物質在水中的溶解性由大到小的順序為________,原因是__________;
已知:多原子分子中,若原子都在同一平面上且這些原子有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域π鍵”(或大π鍵)。大π鍵可用![]()
![]() 表示,其中m、n分別代表參與形成大π鍵的原子個數和電子數,如苯分子中大π鍵表示為
表示,其中m、n分別代表參與形成大π鍵的原子個數和電子數,如苯分子中大π鍵表示為![]()
![]() 。
。
③下列微粒中存在“離域Π鍵”的是_____;
A.O3 B.SO42- C.H2S D.NO3-
④CS2分子中大π鍵可以表示為_______________;
(4)偏釩酸銨加熱分解生成五氧化二釩、氨氣、水。偏釩酸銨的陰離子呈如下圖2所示的無限鏈狀結構,則偏釩酸銨的化學式為_________;
(5)某六方硫釩化合物晶體的晶胞如圖4所示(![]() 表示V,
表示V,![]() 表示S),該晶胞的化學式為VS。圖3 為該晶胞的俯視圖。
表示S),該晶胞的化學式為VS。圖3 為該晶胞的俯視圖。
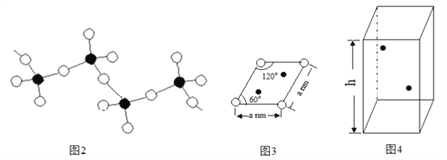
①請在圖4中用![]() 標出V原子的位置;
標出V原子的位置;
②已知晶胞的密度為dg/cm3 ,計算晶胞參數h =_____________cm。(列出計算式即可)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com