
| 元素 | Mn | Fe | |
| 電離能 KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)①鐵是26號元素,電子排布式為1s22s22p63s23p663d6 4s2,d能級上有未成對電子;
②分子晶體熔沸點較低;
③物質熔點可根據晶體類型判斷,原子晶體的>離子晶體>金屬晶體>分子晶體;
同一周期元素電負性從左到右漸增,同一主族元素電負性從上到下逐漸減小;
④根據雜化軌道數=σ鍵數目+孤對電子對數,確定雜化軌道;根據1個單鍵是1個σ鍵,一個雙鍵含有1個σ鍵和1個π鍵,一個三鍵含有1個σ鍵和2個π鍵;
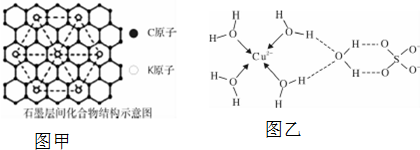
⑤利用均攤法計算碳原子和鉀原子個數之比,注意每個鉀原子被六個三角形共用很關鍵;
(2)第四周期元素中,基態原子的最外層只有1個電子的元素K、Cr、Cu;
(3)鈣元素的焰色反應為磚紅色,進行焰色反應時,吸收能量,鈣離子電子發生躍遷;
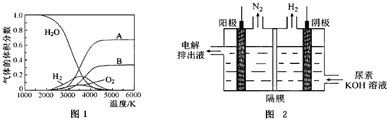
(4)①由圖可知H與O之間存在氫鍵,銅離子與硫酸根之間存在離子鍵;
②銅離子與水分子通過配位鍵形成水合銅離子[Cu(H2O)4]2+;
(5)電離能越大,越不容易失去電子,根據第三電離能可知Mn2+再失去電子比Fe2+更難,電子處于半滿、全滿、全空是更穩定.
解答 解:(1)①鐵是26號元素,電子排布式為1s22s22p63s23p663d6 4s2,根據泡利原理和洪特規則知d能級上有未成對電子,由于d能級有5個軌道,d能級有4個未成對電子,故答案為:4;
②足球烯(C60)熔沸點較低,硬度較小,易溶于苯、酒精等有機溶劑,屬于分子晶體,故答案為:分子晶體;
③金剛石為原子晶體,碳酸鈉為離子晶體,金屬鈉為金屬晶體,二氧化碳為分子晶體,故其熔點大小順序為C>Na2CO3>Na>CO2;
同一周期元素電負性從左到右漸增,同一主族元素電負性從上到下逐漸減小,電負性從大到小的順序是O>C>Na;
故答案為:C>Na2CO3>Na>CO2;O>C>Na;
④丙烯腈(CH2=CH-C≡N)分子中含有6個σ鍵和3個π鍵,數目之比為 2:1;
丙烯腈分子CH2=CH-CN中雙鍵上的碳原子形成3個σ鍵,無孤電子對,sp2雜化,與氮相連的碳原子形成2個σ鍵,無孤電子對,sp雜化;
故答案為:2:1;sp2雜化、sp雜化;
⑤可以取三個鉀原子形成的小三角形為計算單位,其完全占有的碳原子數是4,占有的鉀原子數為$\frac{1}{6}$×3=$\frac{1}{2}$,碳原子數和鉀原子數之比是4:$\frac{1}{2}$=8:1,該化合物化學式為KC8,故答案為:KC8;
2)第四周期元素中,基態原子的最外層只有1個電子的元素K、Cr、Cu,有3種,故答案為:3;
(3)鈣元素進行焰色反應時,吸收能量,鈣離子電子發生躍遷,產生發射光譜為磚紅色;
故答案為:C;
(4)①由圖可知H與O之間存在氫鍵,銅離子與硫酸根之間存在離子鍵;
故答案為:氫鍵;離子鍵;
②銅離子與水分子通過配位鍵形成水合銅離子[Cu(H2O)4]2+,離子方程式為Cu2++4H2O=[Cu(H2O)4]2+,故答案為:Cu2++4H2O=[Cu(H2O)4]2+;
(5)Mn的I3=3248 kJ•mo1-1大于Fe的I3=2957 kJ•mo1-1,所以Mn2+再失去電子比Fe2+更難,原因是Mn2+(3d5)屬于較穩定的半充滿結構,而Fe2+的電子排布為[Ar]3d6,易失去1個電子形成較穩定的半充滿結構.
故答案為:Mn2+再失去電子比Fe2+更難,原因是Mn2+(3d5)屬于較穩定的半充滿結構,而Fe2+的電子排布為[Ar]3d6,易失去1個電子形成較穩定的半充滿結構.
點評 本題考查物質結構和性質,綜合性較強,涉及晶胞計算、原子雜化、配合物、原子核外電子排布等知識點,難點是晶胞計算,側重考查學生空間選項能力及計算能力,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
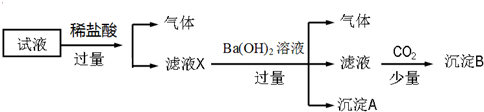
| A. | 無法確定原試液中是否含有Fe3+、K+ | |
| B. | 濾液X中大量存在的陽離子有NH4+、Fe3+、H+和Al3+ | |
| C. | 無法確定沉淀B的成分 | |
| D. | 原溶液中一定存在的離子為NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 下列說法正確的是( )
下列說法正確的是( )| A. | ①② | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 已知 | 解釋與結論 |
| A | 活潑金屬Al、不活潑金屬Cu和濃硝酸可以形成原電池 | Al作正極,Cu作負極 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 該反應在常溫下能自發進行 | 該反應的△H<0 |
| C | 常溫下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,當AgCl、AgBr兩種沉淀共存時,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振蕩,溶液變為黃色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=2的CH3COOH溶液的濃度小于pH=2的鹽酸的濃度 | |
| B. | 向NaHC03溶液中加入少量NaOH固體,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 將任意量的CH3COOH溶液與NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入鋁粉有氣泡產生的溶液中存在離子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物質的量Na2CO3、Ca(OH)2、HCl物質混合反應的離子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca與O元素形成化合物中只有離子鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量的OH-與羥基(-OH)所含電子數相等 | |
| B. | 常溫常壓下,44 g CO2氣體含有氧原子的個數為2 NA | |
| C. | 1 L 0.5 mol•L-1NaHCO3溶液中含有HCO3-的個數為0.5 NA | |
| D. | 11.2 g鐵粉與稀硝酸反應轉移電子數一定為0.6 NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com