
| A. | 含最高價元素的化合物,一定具有氧化性 | |
| B. | 陽離子只有氧化性,陰離子只有還原性 | |
| C. | 失電子越多,還原性越強 | |
| D. | 一種物質是氧化劑時,同時必然有另一種物質是還原劑 |
分析 A.處于元素的最高價,只能得到電子;
B.處于中間價的微粒具有氧化性和還原性;
C.還原性與失去電子的能力強;
D.氧化還原反應中氧化劑、還原劑可能為同種物質.
解答 解:A.處于元素的最高價,只能得到電子,如高錳酸鉀、硝酸中Mn、N元素為最高價,具有氧化性,故A正確;
B.處于中間價的微粒具有氧化性和還原性,如亞鐵離子、亞硫酸根離子,故B錯誤;
C.還原性與失去電子的能力強,與失去電子的多少無關,如Na的還原性比Al強,故C錯誤;
D.氧化還原反應中氧化劑、還原劑可能為同種物質,如氯氣與NaOH反應,故D錯誤;
故選A.
點評 本題考查氧化還原反應,為高頻考點,把握氧化還原反應基本概念及元素的化合價與微粒性質為解答的關鍵,注意結合實例分析,側重分析與應用能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ①的離子濃度為:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | ②c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| C. | ③加入等體積的水稀釋,電離平衡正向移動,c(H+)增大 | |
| D. | ④和③等體積混合,c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
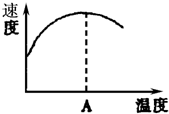 酶是蛋白質,具有蛋白質的特性,酶能催化很多化學反應,如圖表示酶參加的反應中,溫度與反應速率的關系,解釋曲線變化原因升高溫度,增大反應速率,溫度過高,使催化劑失去活性,反應速率減小.
酶是蛋白質,具有蛋白質的特性,酶能催化很多化學反應,如圖表示酶參加的反應中,溫度與反應速率的關系,解釋曲線變化原因升高溫度,增大反應速率,溫度過高,使催化劑失去活性,反應速率減小.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 1913年,德國化學家哈伯實現了合成氨的工業化生產,被稱作解救世界糧食危機的化學天才.現將lmolN2和3molH2投入1L的密閉容器,在一定條件下,利用反應:
1913年,德國化學家哈伯實現了合成氨的工業化生產,被稱作解救世界糧食危機的化學天才.現將lmolN2和3molH2投入1L的密閉容器,在一定條件下,利用反應: 模擬哈伯合成氨的工業化生產.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.
模擬哈伯合成氨的工業化生產.當改變某一外界條件(溫度或壓強)時,NH3的體積分數ψ(NH3)變化趨勢如圖所示.

 的△H=2△H1+△H2,(用含△H1、△H2的代數式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代數式表示).| 容器編號 | 實驗條件 | 平衡時反應中的能量變化 |
| Ⅰ | 恒溫恒容 | 放熱Q1kJ |
| Ⅱ | 恒溫恒壓 | 放熱Q2kJ |
| Ⅲ | 恒容絕熱 | 放熱Q3kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com