
【題目】一定量的濃硝酸與足量銅在燒杯中充分反應,產生NO2、N2O4和NO的混合氣體,這些氣體若與1.12LO2(標準狀況)混合后通入水中,則氣體被水完全吸收。若繼續向燒杯中加入5mol·L-1H2SO4溶液100mL,剩余的銅恰好被溶解,則Cu的總質量為( )
A.9.6gB.19.2gC.24gD.25.6g
【答案】D
【解析】
Cu和濃硝酸反應過程中,Cu失電子生成銅離子、硝酸得電子生成NO2、N2O4、NO,且轉移電子守恒,這些氣體若與1.12LO2(標況)混合后通入水中,氣體被完全吸收,說明氧氣得到的電子等于這些氣體生成硝酸根離子失去的電子,所以氧氣得到的電子等于Cu失去的電子,根據轉移電子得n(Cu)=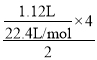 =0.1mol,硝酸溶解的銅的質量為0.1mol×64g/mol=6.4g,根據原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相當于溶液中含有硝酸,能繼續溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>
=0.1mol,硝酸溶解的銅的質量為0.1mol×64g/mol=6.4g,根據原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相當于溶液中含有硝酸,能繼續溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>![]() ,所以氫離子有剩余,根據硝酸根離子計算溶解銅的質量,設溶解Cu的質量為x,則:
,所以氫離子有剩余,根據硝酸根離子計算溶解銅的質量,設溶解Cu的質量為x,則:

192g:2mol=x:0.2mol,解得x=19.2g,故反應過程中一共消耗銅的質量=19.2g+6.4g=25.6g。
答案選D。


 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:
【題目】(1)一定條件下某烴與H2按物質的量之比1:2加成生成C2H5CH (CH3)2,則該烴的結構簡式為(任寫1種)______________________。
(2)分子式為C4H8的烴,核磁共振氫譜圖中有兩個吸收峰,峰面積比為3:1,請寫出符合條件的2種物質的結構簡式___________________、_____________________。
(3)有機物甲的結構簡式如下,它可通過不同的化學反應分別制得結構簡式為乙~庚的物質。

請回答下列問題:
①在甲~庚七種物質中,互為同分異構體的是_________________(填編號,下同),可看作酯類的是___________________。
②寫出由甲生成高分子化合物的方程式:_______________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表的形式多種多樣,下圖是扇形元素周期表的一部分,扇面的18折相當于中學化學常見長式元素周期表的18列,1、2、3、4相當于周期,針對表中所給元素,對照中學化學常見長式元素周期表,回答下列問題:
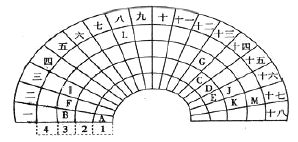
(1)表中金屬性最強的元素在長式元素周期表中的位置是___________,該元素單質與水反應的化學方程式為______________。
(2)表中最高價氧化物對應的水化物酸性最強的是__________(填酸的化學式)。
(3)元素F與K形成化合物的電子式為__________。
(4)寫出元素D最高價氧化物對應水化物的稀溶液與銅單質反應的離子方程式_________。
(5)元素G的最高價氧化物對應水化物跟氫氧化鈉溶液反應的化學方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三室式電滲析法處理含Na2SO4廢水的原理如圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。下列敘述正確的是

A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和H2SO4產品
C. 負極反應為2H2O–4e–=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型漂白劑(如下圖)可用于漂白羊毛等,其中W、Y、Z為不同周期不同主族的短周期元素,W、Y、Z的最外層電子數之和等于X的最外層電子數,W、X對應的簡單離子核外電子排布相同。下列敘述正確的是( )
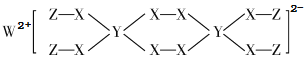
A.工業上通過電解熔融的WX來制得W
B.Z、X兩元素形成的某種化合物可做消毒劑
C.Y的最高價氧化物對應水化物為強酸
D.該漂白劑中各元素均滿足8電子穩定結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的工業原料,液氯儲存區貼有的說明卡如下:
包裝 | 鋼瓶 |
儲運要求 | 遠離金屬粉末、氨、烴類、醇類物質;設置氯氣檢測儀 |
泄漏處理 | NaOH、NaHSO3溶液吸收 |
下列解釋事實的方程式不正確的是
A. 氯氣用于自來水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 電解飽和食鹽水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 濃氨水檢驗泄露的氯氣,產生白煙:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯氣“泄漏處理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C三種常見物質中均含有同一種元素,它們之間有如圖所示的轉化關系(部分反應物質已略去)。下列說法不正確的是
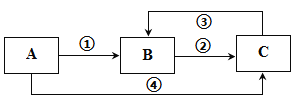
A. 若A是一種兩性氧化物,則B的水溶液可呈酸性,C的水溶液可呈堿性
B. 若A為一種金屬單質時,則反應①、②、③均可為化合反應,反應④可為置換反應
C. 若A、B、C是三種不同類別的固態物質,則B可以是工業上制取A、C的原料
D. 若A、B均是可燃性物質,完全燃燒都生成氣體C,常溫下A溶液pH<7,則將C通入A溶液中,pH值先減小后增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】雄黃(As4S4)和雌黃(As2S3)是提取砷的主要礦物原料,二者在自然界中共生。根據題意完成下列填空:
(1)As2S3和SnCl2在鹽酸中反應轉化為As4S4和SnCl4并放出H2S氣體。若As2S3和SnCl2正好完全反應,As2S3和SnCl2的物質的量之比為____。
(2)上述反應中的氧化劑是____,反應產生的氣體可用_____吸收。
(3)As2S3和HNO3有如下反應:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,則反應中轉移電子的數目為____。
(4)若反應產物NO2與11.2LO2(標準狀況)混合后用水吸收全部轉化成濃HNO3,然后與過量的碳反應,所產生的CO2的量___(填字母)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.無法確
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子結構與性質
(1)元素As與N同族。As的氫化物沸點比NH3的___(填“高”或“低”),其判斷理由是______。
(2)銅原子在基態時的價電子排布式為______。
(3)Fe是人體需要補充的元素之一,試寫出Fe2+的核外電子排布式:_____。與Al同一周期的Na、Mg元素也是人體所需元素,Na、Mg、Al基態原子第一電離能的大小關系____。某同學所畫基態鎂原子的核外電子排布圖如圖![]() ,該同學所畫的電子排布圖違背了______。
,該同學所畫的電子排布圖違背了______。
(4)K元素處于元素周期表的____區,其基態原子中,核外電子占據的電子云輪廓圖為球形的能級有____個。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com