
【題目】NA為阿伏加德羅常數的值。下列說法正確的是 ![]()
![]()
A.0.1molL-1KClO溶液中ClO-的數目小于0.1NA
B.25℃時,100mlpH=8的氨水中NH4+的個數為9.9×10-8NA
C.34g質量分數為4%的H2O2水溶液中含氧原子數目為0.08NA
D.0.3molAgNO3受熱完全分解![]() ,用排水法收集到氣體的分子數為0.25NA
,用排水法收集到氣體的分子數為0.25NA
【答案】B
【解析】
A. 溶液體積未知,無法計算次氯酸根離子個數;
B. 25℃時,100mL pH=8的氨水中存在電荷守恒:![]() ,據此計算NH4+的個數;
,據此計算NH4+的個數;
C. 34g質量分數為4%的H2O2水溶液中,雙氧水中含有氧原子,溶劑水中也含有氧原子由此進行計算;
D. 將生成的氣體NO2和O2通入水中后發生反應生成硝酸,根據AgNO3受熱完全分解生成的氣體中NO2和O2的物質的量計算出消耗氧氣的物質的量,進一步計算收集到的氣體的分子數。
A. 溶液體積未知,無法計算次氯酸根離子個數,A項錯誤;
B.25℃時,100mL pH=8的氨水中存在電荷守恒:c(NH4+)+c(H+)=c(OH-),則:c(NH4+)=c(OH-)- c(H+)=(10-6-10-8)mol/L,氨根離子個數為0.1L×(10-6-10-8)mol/L=9.9×10-8mol,以此100mlpH=8的氨水中NH4+的個數為9.9×10-8NA,B項正確;
C. 34g質量分數為4%的H2O2水溶液中,雙氧水的物質的量為:![]() =0.04mol,雙氧水中含有0.08mol氧原子,由于溶劑水中也含有氧原子,則該溶液中含氧原子數目大于0.08molNA, C項錯誤;
=0.04mol,雙氧水中含有0.08mol氧原子,由于溶劑水中也含有氧原子,則該溶液中含氧原子數目大于0.08molNA, C項錯誤;
D. 將生成的氣體NO2和O2通入水中后發生反應:![]() ,由于0.3molAgNO3受熱完全分解生成的氣體中NO2和O2的物質的量分別為0.3mol和 0.15mol,用排水法收集后,氧氣消耗0.075mol,則剩余0.15mol-0.075mol=0.075mol,因此收集到的分子數為0.075NA個,D項錯誤。
,由于0.3molAgNO3受熱完全分解生成的氣體中NO2和O2的物質的量分別為0.3mol和 0.15mol,用排水法收集后,氧氣消耗0.075mol,則剩余0.15mol-0.075mol=0.075mol,因此收集到的分子數為0.075NA個,D項錯誤。
答案選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】在密閉容器中充入一定量的NO2,發生反應2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化的曲線如圖所示。下列說法正確的是( )
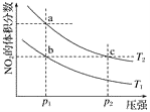
A. a、c兩點的反應速率:a>cB. a、b兩點的轉化率:a<b
C. a、c兩點氣體的顏色:a深,c淺D. 由a點到b點,可以用加熱的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于平衡體系的各說法中不正確的是( )
A.在N2+3H2![]() 2NH3的平衡體系中,縮小體積,平衡向右移動,氨的產率增加
2NH3的平衡體系中,縮小體積,平衡向右移動,氨的產率增加
B.在CH3COOH ![]() CH3COO-+H+的平衡體系中加入CH3COONa固體,平衡向左移動
CH3COO-+H+的平衡體系中加入CH3COONa固體,平衡向左移動
C.純水升溫到100℃時,pH小于7,呈酸性
D.在鹽酸中加入KCl晶體,溶液pH不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、Q、R六種短周期主族元素,原子序數依次增大,Z基態原子核外有三個未成對電子,Y、Z、W分別與X形成常見化合物的分子結構依次為正四面體形、三角錐形和V形,Q的各級電離能如下表,W與R是同族元素。
Q | I1 | I2 | I3 | I4 | I5 | … |
電離能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有關問題:
(1)W原子的外圍電子排布圖為____________。
(2)化合物XYZ的結構式是______。
(3)相同條件下,YW2、RW2兩者在水中的溶解度較大的是__________(寫分子式),原因是_________。
(4)RW3分子中的鍵角_______,RW32-的立體構型是_________形。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個固定容積的密閉容器中,保持一定溫度進行如下反應:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2達到平衡后,生成x mol HBr,在相同條件下若起始時加入的H2、Br2、HBr分別為a、b、c(均不為0)且保持平衡時,各組分含量都不變,以下推斷正確的是
2HBr(g),已知加入1 mol H2和2 mol Br2達到平衡后,生成x mol HBr,在相同條件下若起始時加入的H2、Br2、HBr分別為a、b、c(均不為0)且保持平衡時,各組分含量都不變,以下推斷正確的是
①a、b、c應滿足的關系是4a+c=2b
②平衡時HBr為ax mol
③a、b、c應滿足的關系是a+b=c
④平衡時HBr為![]() x mol
x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣中含有CO、NO等有害氣體。
(1)汽車尾氣中NO生成過程的能量變化如圖示。1molN2和1molO2完全反應生成NO會____(填“吸收”或“放出”)____kJ能量。

(2)通過NO傳感器可監測汽車尾氣中NO的含量,其工作原理如圖所示:(提示:O2-可在此固體電解質中自由移動)

①NiO電極上發生的是___________反應(填“氧化”或“還原”)。
②外電路中,電子是從_________電極流出(填“NiO”或“Pt”).
③Pt電極上的電極反應式為________________________。
(3)一種新型催化劑用于NO和CO的反應:2NO+2CO![]() 2CO2+N2。已知增大催化劑的比表面積可提高該反應速率,為了驗證溫度、催化劑的比表面積對化學反應速率的影響規律,某同學設計了三組實驗,部分條件已經填在下表中。
2CO2+N2。已知增大催化劑的比表面積可提高該反應速率,為了驗證溫度、催化劑的比表面積對化學反應速率的影響規律,某同學設計了三組實驗,部分條件已經填在下表中。
實驗編號 | t(℃) | NO初始濃度 (mol/L) | CO初始濃度(mol/L) | 催化劑的比表面積(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①請將表中數據補充完整:a ___________。
②能驗證溫度對化學反應速率規律的是實驗____________(填實驗序號)。
③實驗Ⅰ和實驗Ⅱ中,NO的物質的量濃度c(NO)隨時間t的變化曲線如圖所示,其中表示實驗Ⅱ的是曲線_______(填“甲”或“乙”)。

(4)在容積固定的絕熱容器中發生反應2NO+2CO2CO2+N2,不能說明已達到平衡狀態的是________(不定項選擇);
A.容器內混合氣體溫度不再變化 B.容器內的氣體壓強保持不變
C.2υ逆(NO)=υ正(N2) D.容器內混合氣體密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-6molL-1
B.濃度均為0.1 molL-1的CuSO4和(NH4)2SO4的混合溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)
C.0.1 molL-1NaF溶液中加入NH4Cl至中性:c(HF)=c(NH3H2O)
D.0.100 molL-1的Na2S溶液中通入HCl氣體,至c(Cl-)=0.100 molL-1(忽略溶液體積的變化及H2S的揮發):c(OH-)-c(H+)=c(HS-)-c(S2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物結構簡式為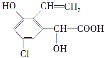 ,下列關于該有機物的說法中不正確的是
,下列關于該有機物的說法中不正確的是
A. 遇FeCl3溶液顯紫色
B. 與足量的氫氧化鈉溶液在一定條件下反應,最多消耗NaOH 3 mol
C. 能發生縮聚反應和加聚反應
D. 1 mol該有機物與濃溴水反應,最多消耗3 mol Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂﹣次氯酸鹽燃料電池的工作原理如圖,該電池反應為:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣下列有關說法正確的是( )

A. 電池工作時,C溶液中的溶質是MgCl2
B. 電池工作時,正極a附近的pH將不斷增大
C. 負極反應式:ClO﹣﹣2e﹣+H2O═Cl﹣+2 OH﹣
D. b電極發生還原反應,每轉移0.1mol電子,理論上生成0.1mol Cl﹣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com