已知A、B、C、D、E均為短周期元素,它們的原子序數依次遞增.A單質是自然界中密度最小的氣體,C元素原子的最外層電子數是次外層的3倍,D原子的最內層電子數和最外層電子數之和等于其次外層電子數,E單質性質活潑;B和C可形成多種氣態化合物.A、B、C三種元素可以形成離子化合物甲,甲是一種常見的化肥,甲可以和氫氧化鈉反應放出無色刺激性氣味氣體乙,乙能使濕潤的紅色石蕊試紙變藍.請回答下列問題:
(1)寫出C元素在周期表中的位置______.
(2)寫出B單質分子的電子式______;乙分子的結構式______.
(3)化肥甲的俗稱是______;甲晶體中含有的化學鍵類型有______.
(4)元素D與元素E相比,非金屬性較強的是______(用元素符號表示),請例舉能證明這一結論的兩個事實______、______.
(5)往甲的濃溶液中加入NaOH的濃溶液并加熱,反應的離子方程式是______ NH3↑+H2O
【答案】
分析:A、B、C、D、E均為短周期元素,它們的原子序數依次遞增.A單質是自然界中密度最小的氣體,則A為氫元素;C元素原子的最外層電子數是次外層的3倍,則C原子有2個電子層,最外層電子數為6,則C為氧元素;D原子的最內層電子數和最外層電子數之和等于其次外層電子數,則D原子最外層電子數為8-2=6,則D為硫元素;E單質性質活潑,原子序數大于硫元素,則E為Cl元素;B和C可形成多種氣態化合物,A、B、C三種元素可以形成離子化合物甲,甲是一種常見的化肥,則B為氮元素,甲為硝酸銨;甲可以和氫氧化鈉反應放出無色刺激性氣味氣體乙,乙能使濕潤的紅色石蕊試紙變藍,則乙為氨氣,以此解答.
解答:解:A、B、C、D、E均為短周期元素,它們的原子序數依次遞增.A單質是自然界中密度最小的氣體,則A為氫元素;C元素原子的最外層電子數是次外層的3倍,則C原子有2個電子層,最外層電子數為6,則C為氧元素;D原子的最內層電子數和最外層電子數之和等于其次外層電子數,則D原子最外層電子數為8-2=6,則D為硫元素;E單質性質活潑,原子序數大于硫元素,則E為Cl元素;B和C可形成多種氣態化合物,A、B、C三種元素可以形成離子化合物甲,甲是一種常見的化肥,則B為氮元素,甲為硝酸銨;甲可以和氫氧化鈉反應放出無色刺激性氣味氣體乙,乙能使濕潤的紅色石蕊試紙變藍,則乙為氨氣,
(1)C為氧元素,氧原子有2個電子層,最外層電子數為6,處于周期表中第二周期ⅥA族,故答案為:第二周期ⅥA族;
(2)B為氮元素,氮氣分子中氮原子之間形成3對共用電子對,氮氣分子的電子式為
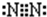
,乙為氨氣分子,分子中氮原子與氫原子之間形成1對共用電子對,氨氣分子的結構式為
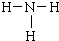
,故答案為:
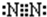
;
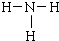
;
(3)甲是硝酸銨,俗稱是硝銨;甲晶體中含有的化學鍵類型有:離子鍵、共價鍵,
故答案為:硝銨;離子鍵、共價鍵;
(4)同周期自左而右非金屬性增強,故非金屬性Cl>S,氯化氫比硫化氫穩定、高氯酸酸性比硫酸強等證明這一結論,
故答案為:Cl;氯化氫比硫化氫穩定;高氯酸酸性比硫酸強;
(5)往硝酸銨的濃溶液中加入NaOH的濃溶液并加熱,反應產生硝酸鈉、氨氣與水,反應的離子方程式是:NH
4++OH
-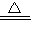
NH
3↑+H
2O,
故答案為:NH
4++OH
-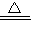
NH
3↑+H
2O.
點評:本題考查結構性質位置關系、物質推斷、常用化學用語等,難度不大,推斷元素是解題的關鍵,注意對基礎知識的理解掌握.

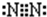 ,乙為氨氣分子,分子中氮原子與氫原子之間形成1對共用電子對,氨氣分子的結構式為
,乙為氨氣分子,分子中氮原子與氫原子之間形成1對共用電子對,氨氣分子的結構式為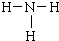 ,故答案為:
,故答案為: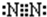 ;
;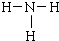 ;
;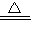 NH3↑+H2O,
NH3↑+H2O,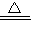 NH3↑+H2O.
NH3↑+H2O.

 名校課堂系列答案
名校課堂系列答案

 已知A、B、C、D、E五種物質有如圖所示的轉化關系(部分反應物及反應條件未列出,若解題時需要,可作合理假設),且五種物質中均含有A元素.
已知A、B、C、D、E五種物質有如圖所示的轉化關系(部分反應物及反應條件未列出,若解題時需要,可作合理假設),且五種物質中均含有A元素. (Ⅰ)通常情況下,微粒A和B為分子,C和E為陽離子,D為陰離子,它們都含有10個電子;B溶于A后所得的物質可電離出C和D;A、B、E三種微粒反應后可得C和一種白色沉淀.請回答:
(Ⅰ)通常情況下,微粒A和B為分子,C和E為陽離子,D為陰離子,它們都含有10個電子;B溶于A后所得的物質可電離出C和D;A、B、E三種微粒反應后可得C和一種白色沉淀.請回答: