
【題目】為了驗證凱庫勒有關苯環結構的觀點,甲同學設計了如下實驗方案。
①按如圖所示的裝置圖連接好各儀器;

②檢驗裝置的氣密性;
③在A中加入適量的苯和液溴的混合液體,再加入少量鐵粉,塞上橡皮塞,打開止水夾K1、K2、K3;
④待C中燒瓶收集滿氣體后,將導管b的下端插入燒杯里的水中,擠壓預先裝有水的膠頭滴管的膠頭,觀察實驗現象。
請回答下列問題。
(1)A中所發生反應的反應類型為_________,能證明凱庫勒觀點錯誤的實驗現象是_______。
(2)裝置B的作用是__________。
(3)C中燒瓶的容積為500 mL,收集氣體時,由于空氣未排盡,最終水未充滿燒瓶,假設燒瓶中混合氣體對H2的相對密度為37.9,則實驗結束時,進入燒瓶中的水的體積為________mL(空氣的平均相對分子質量為29)。
(4)實驗前應對A、B、C三個裝置的氣密性進行逐一檢查,則檢查裝置C氣密性的操作為________。
【答案】取代反應 C中產生“噴泉”現象 除去未反應的苯蒸氣和溴蒸氣 450 關閉K2打開K3,將裝置C中導管b的下端插入水中,雙手捂熱燒瓶,若觀察到導管口有氣泡產生,則說明裝置C的氣密性良好
【解析】
(1)苯與溴在溴化鐵做催化劑的條件下發生取代反應,生成溴苯和溴化氫;
(2)由于反應放熱,苯和液溴均易揮發,溴的存在干擾檢驗H+和Br-;
(3)根據相對密度進行計算;
(4)根據裝置氣密性檢驗的原理解答.
(1)在燒瓶A中,苯與溴在溴化鐵作催化劑的條件下生成溴苯和溴化氫,苯分子里的氫原子被溴原子所代替,該反應為取代反應,生成的溴化氫極易溶于水,所以C中產生“噴泉”現象,證明反應不是加成反應,所以苯分子中不存在碳碳單雙鍵交替,凱庫勒觀點錯誤;
(2)由于苯與液溴發生的取代反應是放熱反應,反應放出熱量,使苯和液溴均易揮發,進入到反應產生的HBr氣體中,可根據苯和溴極易溶于四氯化碳的性質,用四氯化碳除去溴化氫氣體中的未反應的溴蒸氣和苯,以防干擾檢驗H+和Br-的存在;
(3)燒瓶中混合氣體對H2的相對密度為37.9,故燒瓶中混合氣體的平均分子量為M=37.9×2=75.8,設HBr的體積為x,空氣的體積為y,則:![]() =75.8,x+y=500,解得x=450 mL,y=50 mL,進入燒瓶中水的體積為HBr的體積,故進入燒瓶中的水的體積為x=450 mL;
=75.8,x+y=500,解得x=450 mL,y=50 mL,進入燒瓶中水的體積為HBr的體積,故進入燒瓶中的水的體積為x=450 mL;
(4)裝置氣密性檢驗的原理是:通過氣體發生器與附設的液體構成封閉體系,依據改變體系內壓強時產生的現象(如氣泡的生成、水柱的形成、液面的升降等)來判斷裝置氣密性的好壞,所以檢查裝置C的氣密性的操作為關閉K2,打開K3,將裝置C中的b導管插入水中,雙手握住燒瓶,若觀察到b導管口有氣泡產生,則裝置C的氣密性好。


科目:高中化學 來源: 題型:
【題目】化合物H是![]() 受體拮抗劑
受體拮抗劑![]() 的中間體,Nakamura等人設計制備H的合成路線如圖所示:
的中間體,Nakamura等人設計制備H的合成路線如圖所示:

已知:Ⅰ.![]()
![]()
![]() ;
;
Ⅱ.![]() 。
。
回答下列問題:
(1)B中含氧官能團的名稱為______________。
(2)F的分子式為![]() ,則F的結構簡式為___________。
,則F的結構簡式為___________。
(3)②⑤的反應類型分別為____________、____________。
(4)反應①的化學方程式為________________。
(5)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳,寫出化合物H與足量![]() 發生加成反應的產物的結構簡式,并用星號(*)標出其中的手性碳:________________。
發生加成反應的產物的結構簡式,并用星號(*)標出其中的手性碳:________________。
(6)Q與C互為同分異構體,Q遇![]() 溶液發生顯色反應,且苯環上連有兩個取代基,
溶液發生顯色反應,且苯環上連有兩個取代基,![]() 與足量
與足量![]() 溶液反應最多產生
溶液反應最多產生![]() ,則Q的同分異構體有_______種(不含立體異構);其中核磁共振氫譜有6組吸收峰的結構簡式為____________(任寫一種)。
,則Q的同分異構體有_______種(不含立體異構);其中核磁共振氫譜有6組吸收峰的結構簡式為____________(任寫一種)。
(7)參照上述合成路線和信息,設計以苯乙醛為原料(其他試劑任選)制備![]() 的合成路線:____________。
的合成路線:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種合成囧烷(E)的路線如下圖所示:

(1)A中所含官能團的名稱是_____,E的分子式為________。
(2)A→B、B→C的反應類型分別是______、_______。
(3)①在一定條件下,B與足量乙酸可發生酯化反應,其化學方程式為_______。
②C→D為醛酮縮合反應,其化學方程式為_____________________。
(4)F是一種芳香族化合物,能同時滿足下列條件的F的同分異構體有__種。
①1個F分子只比1個C分子少2個氫原子
②苯環上有3個取代基
③1 mol F能與2 mol NaOH反應
寫出其中核磁共振氫譜圖有5組峰,且峰面積比為3∶2∶2∶2∶1的一種物質的結構簡式:_______。
(5)1,2-環己二醇是一種重要的有機合成原料,請參照題中的合成路線,以 和
和![]() 為主要原料,設計合成1,2-環己二醇的合成路線(其他試劑任選)_______。
為主要原料,設計合成1,2-環己二醇的合成路線(其他試劑任選)_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鋅是一種重要的工業原料,廣泛用于農業、化工、電鍍等行業。工業上由鋅渣(主要成分為ZnO、FeO、CuO、PbO等)等工業廢料生產ZnSO4·7H2O的流程如下:
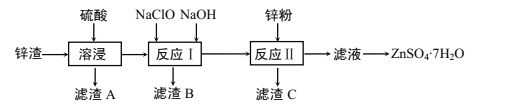
(1)“溶浸”操作中,選用“鋅渣”而不選擇氧化鋅礦粉的原因是______;該操作中不斷通入高溫水蒸氣的目的是________。
(2)“濾渣A”的主要成分是________。
(3)“反應Ⅰ”中,加入NaClO反應的離子方程式為___。
(4)“反應Ⅰ”中,再加入NaOH調節pH約為4.5,則“濾渣B”的主要成分是_____(填化學式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反應Ⅱ”中,加入的鋅粉需用少量稀硫酸處理,原因是_________。
(6)取28.7gZnSO4·7H2O加熱至不同溫度,剩余固體的質量如下表:
溫度/℃ | 100 | 250 | 680 | 930 |
質量/g | 17.90 | 16.10 | 13.43 | 8.10 |
則680℃時所得固體的化學式為_________(填字母標號)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2000年諾貝爾化學獎授予兩位美國化學家和一位日本化學家,以表彰他們在導電塑料領域的貢獻,他們首先把聚乙炔樹脂制成導電塑料。下列關于聚乙炔的敘述錯誤的是( )
A.聚乙炔是以乙炔為單體發生加聚反應形成的高聚物
B.聚乙炔的化學式為![]() 分子中所有碳原子不可能在同一直線上
分子中所有碳原子不可能在同一直線上
C.聚乙炔是一種碳原子之間以單雙鍵交替結合的鏈狀結構的物質
D.聚乙炔樹脂不加任何填充物即可成為電的良導體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物A1和A2分別和濃H2SO4在一定溫度下共熱都只生成烴B,B的蒸氣密度是同溫同壓下H2密度的59倍,在催化劑存在下,B的一元硝化產物有三種。有關物質之間的轉化關系如下:
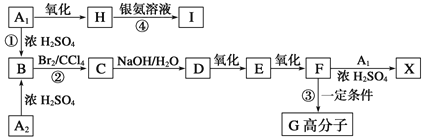
(1)反應②屬于____________反應,反應④屬于__________反應(填反應類型)。
(2)寫出下列兩種物質的結構簡式:A2__________;X_________。
(3)寫出下列反應的化學方程式:反應④____________;③___________。
(4)化合物J是比化合物F多一個碳原子的F的同系物,化合物J有多種同分異構體,其中滿足下列條件的同分異構體種類有_____種,寫出其中任意一種的結構簡式:_____。
①苯環上有兩個取代基;②能使FeCl3溶液顯色;③含有酯基。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鉬具有高強度、高熔點、耐磨抗腐性,用于制火箭、衛星的合金構件。鉬酸鈉晶體(Na2MoO42H2O)是一種重要的金屬緩蝕劑。利用鉬礦(主要成分MoS2,還含少量鈣、鎂等元素)為原料冶煉金屬鉬和鉬酸鈉晶體的主要流程圖如下:
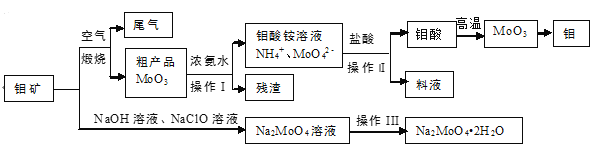
(1)Na2MoO42H2O中鉬元素的價態為___,煅燒產生的尾氣引起的環境危害主要是_______。
(2)用濃氨水溶解粗產品的離子方程式是_________,由圖中信息可以判斷MoO3是___氧化物。(填“酸性”、“堿性”或“兩性”)
(3)操作I是_____,操作Ⅱ所得的鉬酸要水洗,檢驗鉬酸是否洗滌干凈的方法是____。
(4)采用 NaClO氧化鉬礦的方法將礦石中的鉬浸出,該過程放熱。
①請配平以下化學反應:
___NaClO +___MoS2 + ___NaOH →___Na2MoO4 +___Na2SO4 +___NaCl +___H2O。
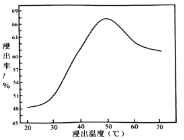
②鉬的浸出率隨著溫度變化如圖,當溫度高于50℃后浸出率降低的可能原因是______(寫一點)。
(5)鋰和MoS2可充電電池的工作原理為xLi+nMoS2![]() Lix(MoS2)n,則電池充電時陽極上的電極反應式為______。
Lix(MoS2)n,則電池充電時陽極上的電極反應式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從葡萄籽中提取的原花青素結構如圖,具有生物活性,如抗氧化和自由基清除能力等。有關原花青素的下列說法不正確的是
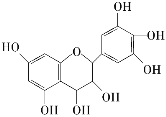
A. 該物質可以看作醇類,也可看做酚類
B. 1 mol該物質可與4 mol Br2反應
C. 1 mol該物質可與7 mol NaOH反應
D. 1 mol該物質可與7 mol Na反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是
2NH3(g) ΔH<0,下列各項對示意圖的解釋與圖像相符的是

A. ①壓強對反應的影響(p2>p1) B. ②溫度對反應的影響
C. ③平衡體系增加N2對反應的影響 D. ④催化劑對反應的影響
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com