
【題目】寫出下列物質變化的化學方程式。并按要求填空
(1)用硝酸銀溶液檢驗氯化鈉_______________。
(2)鐵絲在氯氣中燃燒,標出電子轉移方向和數目________,氧化劑________,還原劑_____。
(3)氯氣通入碘化鉀溶液中,標出電子轉移方向和數目______,氧化劑________,還原劑_____。
(4)用二氧化錳和濃鹽酸反應制取氯氣__________________,其中二氧化錳發生了_____(填‘氧化’或‘還原’)反應;鹽酸是_____(填‘氧化’或‘還原’)劑,其中每4 mol HCl中只有__mol發生了_____(填‘氧化’或‘還原’)反應。
【答案】AgNO3+NaCl=NaNO3+AgCl↓ Cl2Fe
Cl2Fe Cl2KIMnO2+4HCl(濃)
Cl2KIMnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O還原還原2氧化
MnCl2+Cl2↑+2H2O還原還原2氧化
【解析】
(1)用硝酸銀溶液檢驗氯化鈉產生氯化銀白色沉淀,反應的化學方程式為AgNO3+NaCl=NaNO3+AgCl↓。
(2)鐵絲在氯氣中燃燒生成氯化鐵,鐵元素化合價從0價升高到+3價,失去3個電子,鐵是還原劑,氯元素化合價從0價降低到-1價,得到1個電子,氯氣是氧化劑,根據電子得失守恒可知電子轉移方向和數目可表示為 。
。
(3)氯氣通入碘化鉀溶液中生成氯化鉀和單質碘,氯元素化合價從0價降低到-1價,得到1個電子,氯氣是氧化劑,碘元素化合價從-1價升高到0價,失去1個電子,碘化鉀是還原劑,則根據電子得失守恒可知電子轉移方向和數目可表示為 。
。
(4)用二氧化錳和濃鹽酸反應制取氯氣的化學方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O,其中Mn元素化合價從+4價降低到+2價,得到2個電子,二氧化錳發生了還原反應;氯元素化合價從-1價升高到0價,失去1個電子,則氯化氫是還原劑。反應中還生成氯化錳,則根據方程式可知每4 mol HCl中只有2 mol發生了氧化反應。
MnCl2+Cl2↑+2H2O,其中Mn元素化合價從+4價降低到+2價,得到2個電子,二氧化錳發生了還原反應;氯元素化合價從-1價升高到0價,失去1個電子,則氯化氫是還原劑。反應中還生成氯化錳,則根據方程式可知每4 mol HCl中只有2 mol發生了氧化反應。


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案科目:高中化學 來源: 題型:
【題目】秦皮是一種常用的中藥,具有抗炎鎮痛、抗腫瘤等作用。“秦皮素”是其含有的一種有效成分,結構簡式如下圖所示,有關其性質敘述不正確的是

A. 1mol該有機物能與5mol H2反應
B. 該有機物分子式為C10H8O5
C. 該有機物能發生加成;氧化,取代等反應
D. 分子中有四種官能團
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列有關說法正確的是( )
A. 在常溫常壓下,11.2 L O2含有的分子數為0.5NA
B. 71 g Cl2所含原子數為2NA
C. 標準狀況下,22.4 L H2O含有的分子數為NA
D. 25℃、101Kpa時,64g SO2中含有的分子數為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈉在氯氣中產生________色的煙,反應的化學方程式為_____________________,生成物氯化鈉中的化學鍵是__________鍵,該化合物是_________(填“離子”、“共價”)化合物,氯化鈉的電子式為_____________。氫氣在氯氣中燃燒產生______色的火焰,反應的化學方程式為_______,氯化氫分子中的化學鍵是_______鍵,該化合物是________(填“離子”、“共價”)化合物,氯化氫分子的電子式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由下圖分析,下列結論正確的是_____。
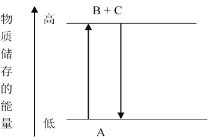
A.A→B+C,B+C→A,兩個反應吸收或放出的能量相等
B.A→B+C是放熱反應
C.A→B+C是吸熱反應
D.A具有的能量高于B+C的能量總和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的數值。下列說法正確的是
A. 1 mol羥基中含有l0NA個電子
B. 常溫下,22.4 L CH4在O2中完全燃燒,生成NA個CO2分子
C. 標準狀況下,18 g H2O中所含的氧原子數為NA
D. 0.2 mol L-1的NH4Cl溶液中含有0.2NA個NH4+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家預測,月球的土壤中吸附著數百萬噸![]() ,100噸
,100噸![]() 核聚變釋放的能量相當于目前人類一年消耗的能量。下列說法正確的是
核聚變釋放的能量相當于目前人類一年消耗的能量。下列說法正確的是
A. ![]() 的最外層的最外層電子數為2,具有較強的金屬性
的最外層的最外層電子數為2,具有較強的金屬性
B. ![]() 位于周期表第一周期第ⅡA族
位于周期表第一周期第ⅡA族
C. 每個氦分子中含有的質子數為2、中子數為1
D. 該原子核中質子數為2、中子數為3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com