
(14分)工業上一般在恒容密閉容器中可以采用下列反應合成甲醇:
(1)判斷反應達到平衡狀態的依據是(填字母序號,下同)__________。
A. 生成的速率與消耗
的速率相等
B. 混合氣體的密度不變
C. 混合氣體的相對平均分子質量不變
D. 、
、
的濃度都不再發生變化
E. 氣體的壓強不再改變
(2)下表所列數據是反應在不同溫度下的化學平衡常數(K)。
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中數據判斷該反應的△H__________0(填“>”、“=”或“<”);
②某溫度下,將和
充入
的密閉容器中,充分反應后,達到平衡時測得
,則CO的轉化率為__________,此時的溫度為__________。
(3)要提高CO的轉化率,可以采取的措施是__________。
a. 升溫 b. 加入催化劑 c.增加CO的濃度
d. 恒容下加入 使壓強變大 e. 恒容下加入惰性氣體使壓強變大 f. 分離出甲醇
(4)在250℃時,某時刻測得該溫度下的密閉容器中各物質的物質的量濃度見下表:
| CO | | |
| 0.5 mol·L—1 | 2mol·L—1 | 6mol·L—1 |
此時反應的正、逆反應速率的關系是:v(正) v(逆)(填“大于”“小于”或“等于”)。
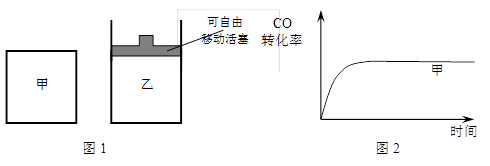
(5)如圖1所示,甲為恒容密閉容器,乙為恒壓密閉容器。在甲、乙兩容器中分別充入等物質的量的H2和CO,使甲、乙兩容器初始容積相等。在相同溫度下發生上述反應,并維持反應過程中溫度不變。已知甲容器中CO的轉化率隨時間變化的圖像如圖2所示,請在圖2中畫出乙容器中CO的轉化率隨時間變化的圖像。
(1)CDE(2分)
(2)①<(2分)②80%
(2分)250℃(2分)
(3)df(2分)
(4)小于(2分)
(5)(2分)
解析:(1)A中的速率方向是相同的,不能說明。混合氣的密度是混合氣的質量和容器容積的比值,在反應過程中,均是不變的,即混合氣的密度也是不變的。混合氣體的相對平均分子質量是混合氣的質量和混合氣總的物質的量的比值,質量不變,氮總的物質的量是變化的,所以當混合氣體的相對平均分子質量不變時可以說明。濃度不再發生變化,就說明正逆反應速率相等,可以說明。反應前后體積變化,所以壓強在反應過程中是變化的,E可以說明。
(2)升高溫度,平衡常數減小,說明反應向逆反應方向移動,即正反應是放熱反應,△H小于0。
起始量(mol) 2 6 0
轉化量(mol) 1.6 3.2 1.6
平衡量(mol) 0.4 2.8 1.6
所以CO的轉化率是![]()
平衡常數為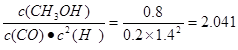
所以溫度是250℃
(3)因為反應是體積增大的、放熱的可逆反應,所以升高溫度平衡向逆反應方向移動,轉化率降低。催化劑不能影響平衡,轉化率不變。增加CO的濃度,平衡向正反應方向移動,但CO的轉化率降低。增大氫氣濃度,平衡向正反應方向移動,CO的轉化率增大。恒容下加入惰性氣體使壓強變大,但反應物的濃度并沒有變化,平衡不移動,轉化率不變。分離出甲醇,平衡向正反應方向移動,CO的轉化率增大。答案選df。
(4)此時![]() >2.041,所以反應選逆反應方向移動,即正反應速率小于逆反應速率。
>2.041,所以反應選逆反應方向移動,即正反應速率小于逆反應速率。
(5)反應是體積減小的可逆反應,所以在反應過程中,加中壓強減小,而乙中壓強是不變的。壓強大,反應速率快,到達平衡的時間短、壓強大,有利于平衡向正反應方向移動,CO的轉化率大,所以圖像為。


科目:高中化學 來源: 題型:閱讀理解
 CH3OH(g)△H
CH3OH(g)△H| 溫度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 的 數 據 |
CH3OH濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | akJ | bkJ | ckJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 催化劑 |
| 加熱 |
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡時數據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | akJ | bkJ | ckJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com