
短周期元素A、B、C、D、E在元素周期表中的位置如下圖所示,B是形成化合物種類最多的元素。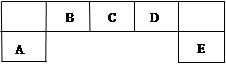
請回答下列問題:
(1)描述D在元素周期表中的位置:_____________________
(2)比較A、C、D元素簡單離子半徑的大小:______>______>______(填微粒符號)
(3)E的氫化物與其最高價氧化物的水化物的鉀鹽共熱能發生反應,生成一種氣體單質,反應的化學反應方程式為_______________________________________________.
(4)F與D同主族且相鄰,請說出D的氫化物比F的氫化物穩定的根本原因:______________;
用高能射線照射液態水時,一個水分子能釋放出一個電子,同時產生一種具有較強的氧化性的陽離子,試寫出陽離子的電子式:________,寫出該陽離子與F氫化物的水溶液反應的離子方程式:__________________________________________________________。
(5)在Fe和Cu 的混合物中加入一定量的C的最高價氧化物的水化物稀溶液,充分反應后剩余金屬m1g,再向其中加入一定量的稀硫酸,充分反應后,剩余金屬m2g。下列說法正確的是( )
A.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Cu2+
B.加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+
C.m1一定大于m2
D.剩余固體m1g中一定有單質銅,剩余固體m2g中一定沒有單質銅
(1)第二周期第ⅥA族(2分)(2)N3->O2->Al3+(2分)(3)8HCl+KClO4 KCl+4Cl2↑+4H2O(2分)(4)氧的非金屬性比硫強(2分)(2分)2H2O++H2S=S↓+2H2O+2H+(2分)(5)BC(2分)
KCl+4Cl2↑+4H2O(2分)(4)氧的非金屬性比硫強(2分)(2分)2H2O++H2S=S↓+2H2O+2H+(2分)(5)BC(2分)
解析試題分析:由題意可知,A為鋁元素,B為碳元素,C為氮元素,D為氧元素,E為氯元素。Fe和Cu 的混合物加入稀硝酸中,Fe的還原性比銅強故優先反應,則剩余金屬可能是鐵與銅的混合物或者銅, 故加入稀硫酸前,加入稀硫酸后的溶液中肯定都有Fe2+,可能含有Cu2+,陰離子為硝酸根離子,再加入稀硫酸使溶液呈酸性,是剩余金屬繼續與溶液反應,則m1一定大于m2,充分反應后,剩余金屬m2一定有銅可能有鐵。
考點:元素周期律


科目:高中化學 來源: 題型:填空題
A、B、C是中學化學常見的三種物質,它們之間的相互轉化關系如下(部分反應條件及產物略去)。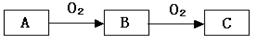
(1)若A是一種黃色單質固體,則B→C的化學方程式為 。
(2)若A是一種活潑金屬,C是淡黃色固體,則C的名稱為 ,試用化學方程式表示該物質與二氧化碳氣體的反應 。將C長期露置于空氣中,最后將變成物質D,D的化學式為 。現有D和NaHCO3的固體混合物10g,加熱至質量不再改變,剩余固體質量為9.38 g,D的質量分數為 。
(3)若C是紅棕色氣體,A可能是一種能使濕潤的紅色石蕊試紙變藍的氣體。下圖是實驗室制取A氣體的裝置,請結合所學知識,回答下列問題: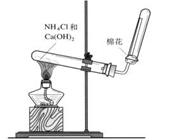
①收集A的方法是 ,驗證A是否已經收集滿的方法是 (任寫一種)。
②寫出實驗室制取A的化學方程式 。
③若有5.35g氯化銨參加反應,則產生的A氣體在標準狀況下的體積為 L。
④試寫出C與水反應的化學方程式 ,反應可得到酸X,X是 電
解質(填“強”或“弱”)。如下圖:足量X的濃溶液與Cu反應,寫出燒瓶中發生反應的離子方程式 。實驗完畢后,試管中收集到的氣體的主要成分為 (寫化學式)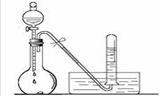
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某固體混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一種或幾種組成,現對該混合物做如下實驗,所得現象和有關數據如圖所示(氣體體積數據已換算成標準狀況下的體積):
回答下列問題:(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)寫出反應⑤的離子方程式:________________________。
(4)請根據圖中數據分析,原固體混合物的成分為 (寫化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
噴泉是一種常見的實驗現象(如下圖),其產生原因是存在壓強差。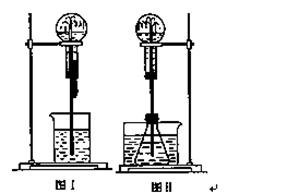
(1)圖Ⅰ為化學教學中所用的噴泉實驗裝置。在燒瓶中充滿干燥氣體,膠頭滴管及燒杯中分別盛有液體。下列組合中不可能形成噴泉的是(填編號字母) 。
A.HCl 和H2O B.O2和H2O
C.SO2和NaOH溶液 D.CO2和NaOH溶液
(2)某學生積極思考產生噴泉的其他辦法,并設計了圖Ⅱ所示的 裝置。
在圖Ⅱ的錐形瓶中,分別加入足量的下列物質,反應后可能產生 噴泉的是(填編號字母) 。
A.CaCO3和稀H2SO4 B.NaOH與稀HCl
C.Zn與稀HCl D.NaCl與稀HNO3
(3)比較圖Ⅰ和圖Ⅱ兩套裝置,從產生噴泉的原理分析,二者的不同點在于 。
(4)城市中常見的人造噴泉及火山爆發的原理與上述(填“圖Ⅰ”或“圖Ⅱ”)裝置的原理相似。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
X、Y、Z、V、W是元素周期表前四周期中的五種常見元素,其相關信息如下表;
| 元素 | 相關信息 |
| X | X是形成化合物種類最多的元素,它的一種氣態氧化物能產生溫室效應 |
| Y | Y是地殼中含量最多的元素 |
| Z | Z和Y形成的一種化合物Z2Y2為淡黃色粉末,可作為呼吸面具里氧氣的來源 |
| V | V的單質是淡黃色固體,是黑火藥的一種主要成分 |
| W | W的單質是人們最早發現和使用的金屬之一 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲、乙、丙、丁四種物質中,甲、乙、丙均含有某種相同的元素,它們之間具有如下轉化關系(反應條件和部分產物已略去):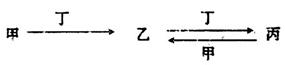
(1)若甲為常見金屬單質,甲和丁的稀溶液反應生成無色氣體,該氣體遇空氣變為紅棕色。
①檢驗丙溶液中金屬陽離子的試劑為________(填試劑名稱)。
②向含n mol丁的稀溶液中加入m mol單質甲,二者恰好完全反應(假設還原產物只有上述無色氣體),則n:m可能為__________(填代號)。
a.3:2 b.4:1 c.5:1 d.3:1
③常溫下,丁的濃溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲為氯堿工業的產品,含丙的某種藥品可用于治療胃酸過多。
①鑒別等濃度的乙溶液和丙溶液,可選用的試劑為________(填代號)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②將甲、乙、丙三種溶液混合,向混合液中逐滴加入一定濃度的鹽酸,生成氣體的體積(標準狀況)與加入鹽酸的體積關系如下圖所示: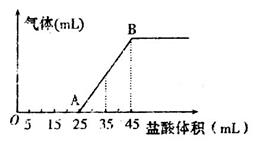
寫出OA段所發生反應的離子方程式__________________________,當加入35mL鹽酸時,產生氣體的體積為22.4mL(標準狀況),則鹽酸的物質的量濃度為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 、
、 、
、 、
、 、
、 是五種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示。Z是地殼中含量最高的元素。W原子最外層電子數是K層電子數的2倍。
是五種常見的短周期元素,其原子半徑隨原子序數變化如下圖所示。Z是地殼中含量最高的元素。W原子最外層電子數是K層電子數的2倍。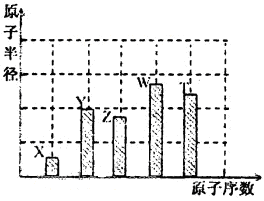
(l)W在周期表中的位置為_______________________。
(2)Y、Z的10電子氫化物分子中均含有的化學鍵類型為___________;其穩定性較強的是___________
(填化學式)。
(3)用化學方程式表示YZ2形成酸雨的反應:______________________。
用精密pH試紙(精確到0.l)測定酸雨pH的操作是______________________。
(4)常溫下用1 mol/L100 mL NaOH溶液恰好完全吸收0.1molTZ2氣體,此反應的離子方程式為
______________________;此時溶液pH<7的原因是___________________________。
(5)在25℃、101kPa下,己知W與X形成的氣態化合物與足量Z2點燃完全反應(生成W的最高價
化合物),恢復至原狀態,平均每轉移l mol e_放熱190 kJ,該反應的熱化學方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
用如圖所示裝置進行實驗(夾持裝置已略去)。請回答下列問題: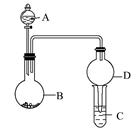
(1)若A中為濃硝酸,B中為銅單質,C中為氫氧化鈉溶液。將濃硝酸滴入B中,則B中發生反應的化學方程式為。
(2)若A中為濃氨水,B中為生石灰,C中為明礬溶液。
①將濃氨水逐滴滴入B中,可產生大量氨氣,原因可能是(填序號)。
a.生石灰和濃氨水反應產生氨氣,氨氣易溶于水
b.生石灰和水反應,消耗水,使氨氣的溶解量減少
c.反應放出大量熱,使氨氣在水中的溶解度明顯降低
②C中通入過量氨氣時,相應的離子方程式為。
(3)若A中為水,B中為過氧化鈉,C中為酸性淀粉碘化鉀溶液,將水滴入B中后,B中的實驗現象為;若C中溶液變為藍色,則C中發生反應的離子方程式為。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com