

分析 (1)根據醋酸是弱電解質,加水稀釋有利于電離平衡正向移動,而鹽酸是強電解質,不存在電離平衡;
(2)①Kw的大小只受溫度影響;溶液中離子濃度越大導電能力越強;
②Ka的大小只受溫度影響,溫度不變其大小不變,加入醋酸鈉,醋酸根離子濃度增大;
(3)醋酸為弱酸,pH均為2的鹽酸和醋酸溶液,兩種溶液中H+離子濃度相等,則醋酸濃度大與鹽酸,分別中和等體積、等物質的量濃度的氫氧化鈉溶液,當氫氧化鈉恰好被完全中和時,消耗的兩種酸的物質的量相等,根據n=C×V比較二者的體積關系;
(4)難溶電解質的溶解平衡及沉淀轉化是溶解度大的物質向溶解度小的物質轉化;
(5)據Ka的大小判斷其酸性強弱;要檢驗酸性強弱,可以采用多種方法,例如利用水解原理(酸越弱相應的強堿鹽就越易水解),也可以利用較強的酸制取較弱的酸來檢驗.
解答 解:(1)因為醋酸是弱酸,加水后反應正向進行,醋酸電離度增加,加水后,氫離子濃度在減小的過程中有增大的趨勢,而鹽酸是強酸在水中完全電離,加水后,氫離子濃度只是在減小,所以要使稀釋后兩溶液pH值相同,就必須使m<n,故答案為:<;
(2)①Kw的大小只受溫度影響,相同溫度下,Kw(a)=Kw(c);在醋酸溶液和鹽酸溶液中,pH越小,離子濃度越大,溶液導電能力越強,故答案為:=;a>b>c;
②Ka的大小只受溫度影響,溫度不變其大小不變,加入醋酸鈉,醋酸根離子濃度增大,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值減小,故答案為:減小;
(3)醋酸為弱酸,pH均為2的鹽酸和醋酸溶液,兩種溶液中H+離子濃度相等,則醋酸濃度大與鹽酸,設鹽酸的濃度為C1,醋酸的濃度為C2,則C1<C2,分別中和氫氧化鈉時,醋酸消耗的氫氧化鈉的物質的量等于鹽酸,故答案為:<;
(4)難溶電解質的溶解平衡及沉淀轉化是溶解度大的物質向溶解度小的物質轉化,ZnS或PbS能轉化為CuS,所以CuS的溶解度小于ZnS或PbS的溶解度,
故答案為:CuS的溶解度小于ZnS或PbS的溶解度;
(5)H2SO3的電離常數Ka2:=6.3×10-8,H2CO3的電離常數Ka1=4.2×10-7,所以等物質的量濃度的NaHSO3和H2CO3溶液,酸性較強的是碳酸;要檢驗酸性強弱,可以采用多種方法,例如利用水解原理(酸越弱相應的強堿鹽就越易水解),也可以利用較強的酸制取較弱的酸來檢驗,三種參考方案如下:
方案一:配制相同物質的量濃度的NaHSO3和NaHCO3溶液,用酸度計(或pH試紙)測兩溶液的pH.前者的pH小于后者,證明H2SO3酸性強于H2CO3.
方案二:將SO2氣體依次通過NaHCO3(Na2CO3)溶液、酸性KMnO4溶液、品紅溶液、澄清石灰水.品紅溶液不褪色、且澄清石灰水變混濁,證明H2SO3酸性強于H2CO3.
方案三:將CO2氣體依次通過NaHSO3(Na2SO3)溶液、品紅溶液.品紅溶液不褪色,證明H2SO3酸性強于H2CO3.
故答案為:碳酸;方案一:配制相同物質的量濃度的NaHSO3和NaHCO3溶液,用酸度計(或pH試紙)測兩溶液的pH.前者的pH小于后者,證明H2SO3酸性強于H2CO3.
方案二:將SO2氣體依次通過NaHCO3(Na2CO3)溶液、酸性KMnO4溶液、品紅溶液、澄清石灰水.品紅溶液不褪色、且澄清石灰水變混濁,證明H2SO3酸性強于H2CO3.
方案三:將CO2氣體依次通過NaHSO3(Na2SO3)溶液、品紅溶液.品紅溶液不褪色,證明H2SO3酸性強于H2CO3.
點評 本題主要考查水的離子積常數、弱電解質的電離常數只受溫度影響、常見的基本實驗操作、儀器的使用、離子的除雜和實驗方案設計,綜合性強.


科目:高中化學 來源: 題型:選擇題
| A. | 穩定性:HF>HCl>HBr>HI | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 離子半徑:N3->O2->F->Na+>Mg2+ | D. | 沸點:F2>Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是A、B、C三種固體物質的溶解度曲線圖,請回答:
如圖是A、B、C三種固體物質的溶解度曲線圖,請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0•12mol | B. | 0•08mol | C. | 0•04mol | D. | 0•8mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化劑與還原劑的物質的量之比為1:5 | |
| B. | 該過程說明KMnO4酸化時不能滴加鹽酸 | |
| C. | 反應過程中轉移2mol電子時,產生Cl2的體積約為22.4L | |
| D. | 若把該反應設計成原電池,則正極反應為MnO4-+5e-+8H+═Mn2++4H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

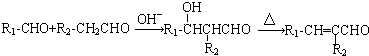
 .反應①~⑤中屬于取代反應的有③④⑤(填序號).
.反應①~⑤中屬于取代反應的有③④⑤(填序號). .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 60 g SiO2晶體中含有Si-O鍵數目為2NA | |
| B. | 常溫常壓下,1.6 9 O2和O3的混合氣體所含電子數為0.8NA | |
| C. | 1 mol/L AICl3溶液中,所含Al3+數目小于NA | |
| D. | 密閉容器中2 mol NO與l mol 02充分反應,產物的分子數為2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com