
【題目】C、CH4是常用的燃料,它們每1mol分別完全燃燒生成CO2(g)及H2O(l)時,放出的熱量分別為393.5 kJ、890.3 kJ。計算說明:(寫出必要的文字說明和重要演算步驟,只寫出最后答案的不能得分。有數值計算的題,數值結果保留到小數點后1位。)
(1)1 g C完全燃燒時放出的熱量。
(2)完全燃燒相同質量的C和CH4,哪種燃料放出熱量較多?
【答案】
(1)1 g C完全燃燒時放出的熱量為 ![]() = 32.8 kJ 數值結果保留到小數點后1位
= 32.8 kJ 數值結果保留到小數點后1位
(2)因1 g CH4完全燃燒時放出的熱量為 ![]() = 55.6 kJ 故CH4放出熱量較多。
= 55.6 kJ 故CH4放出熱量較多。
【解析】本題考查化學計算,(1)根據要求,1molC燃燒的熱化學反應方程式為:C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1,因此1gC完全燃燒放出的熱量是393.5/12kJ≈32.8kJ·mol-1;(2)1mol甲烷燃燒的熱化學反應方程式為CH4(g)+O2(g)=CO2(g)+H2O(l) △H=-890.3kJ·mol-1,1g甲烷燃燒放出的熱量是890.3/16kJ≈55.6kJ,因此等質量時甲烷放出的熱量多。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】SO2和氮氧化物的轉化和綜合利用既有利于節約資源,又有利于保護環境。
⑴H2還原法是處理燃煤煙氣中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
寫出SO2(g)和H2(g)反應生成S(s)和H2O(g)的熱化學方程式:_____________。
⑵20世紀80年代Townley首次提出利用電化學膜脫除煙氣中SO2的技術:將煙氣預氧化使SO2轉化為SO3,再將預氧化后的煙氣利用如圖所示原理凈化利用。
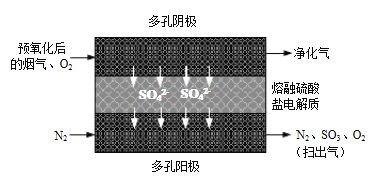
①陰極反應方程式為_____________。
②若電解過程中轉移1mol電子,所得“掃出氣”用水吸收最多可制得質量分數70%的硫酸_____________g。
⑶利用脫氮菌可凈化低濃度NO廢氣。當廢氣在塔內停留時間均為90s的情況下,測得不同條件下NO的脫氮率如圖Ⅰ、Ⅱ所示。
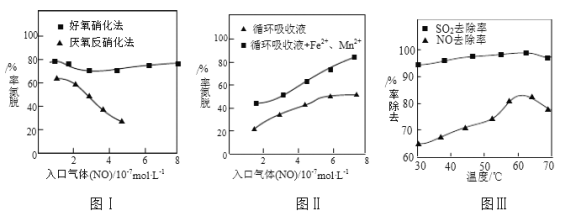
①由圖I知,當廢氣中的NO含量增加時,宜選用____________法提高脫氮效率。
②圖Ⅱ中,循環吸收液加入Fe2+、Mn2+提高了脫氮的效率,其可能原因為_____________。
⑷研究表明:NaClO2/H2O2酸性復合吸收劑可同時有效脫硫、脫硝。圖Ⅲ所示為復合吸收劑組成一定時,溫度對脫硫脫硝的影響。
①溫度高于60℃后,NO去除率隨溫度升高而下降的原因為_____________。
②寫出廢氣中的SO2與NaClO2反應的離子方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國自主研發的新一代動車組在京滬高鐵上跑出過486.1公里的世界列車最高時速,這得益于全路鋪設的優質無縫平滑的超長鋼軌。下列有關說法不正確的是
A. 制造鋼軌的材料是鋼,鋼是用量最大的合金
B. 鋼的熔點比鐵的熔點高,而鐵的用途更廣泛
C. 我國在商代就開始使用銅合金
D. 鋁合金的強度、硬度比組成合金各成分金屬的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將1 mol的CuSO4·5H2O(s)溶于水會使溶液溫度降低,熱效應為ΔH1,將1 mol的CuSO4(s)溶于水會使溶液溫度升高,熱效應為ΔH2;CuSO4·5H2O受熱分解的化學方程式為CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),熱效應為ΔH3。則下列判斷正確的是
CuSO4(s)+5H2O(l),熱效應為ΔH3。則下列判斷正確的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已建立化學平衡的某可逆反應,當改變條件使化學平衡向正反應方向移動時,下列有關敘述正確是( )
①生成物的質量分數一定增加
②生成物的產量一定增大
③反應物的轉化率一定增大
④反應物的濃度一定降低
⑤正反應速率一定大于逆反應速率
⑥平衡常數一定增大
A.①② B.③⑤ C.②⑤ D.④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于判斷過程的方向的說法正確的是
A.所有自發進行的化學反應都是放熱反應
B.高溫高壓下可以使石墨轉化為金剛石是自發的化學反應
C.由能量判據和熵判據組合而成的復合判據,將更適合于所有的過程
D.同一物質的固、液、氣三種狀態的熵值相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)反應Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常數為K1
FeO(s)+CO(g) ΔH1,平衡常數為K1
反應Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常數為K2在不同溫度時K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常數為K2在不同溫度時K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反應CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常數K,則ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述計算可知,反應CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常數K,則ΔH=___________(用ΔH1和ΔH2表示),K=___________(用K1和K2表示),且由上述計算可知,反應CO2(g)+H2(g)![]() CO(g)+H2O(g)是________反應(填“吸熱”或“放熱”)。
CO(g)+H2O(g)是________反應(填“吸熱”或“放熱”)。
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示:
FeO(s)+CO(g) ΔH>0,CO2的濃度與時間的關系如圖所示:
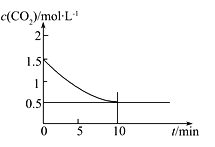
①該條件下反應的平衡常數為___________;若鐵粉足量,CO2的起始濃度為2.0 mol·L-1,則平衡時CO2的濃度為____________mol·L-1。
②下列措施中能使平衡時![]() 增大的是__________(填序號) 。
增大的是__________(填序號) 。
A.升高溫度 B.增大壓強 C.再充入一定量的CO2 D.再加入一定量鐵粉
③一定溫度下,在一個固定容積的密閉容器中發生上述反應,下列能判斷該反應達到化學平衡狀態的是________(填字母)。
a.容器中的壓強不變
b.氣體的密度不再改變
c.v正(CO2)=v逆(CO)
d.c(CO2)=c(CO)
e.容器內氣體總物質的量不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列圖象及其相關說法正確的是( )
圖①: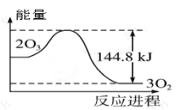 圖②:
圖②: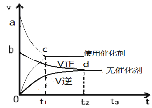
圖③: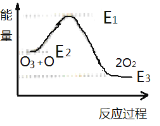 圖④ :
圖④ :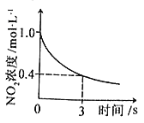
A.據圖①可判斷:2O3(g)=3O2(g);△H= - 44.8KJ/mol
B.據圖②可判斷:某反應在使用催化劑時比無催化劑時反應速率大,且面積Saco>Sbdo
C.據圖③可判斷: 2O2(g)═O3(g)+O(g)△H>0
D.據圖④可判斷:2NO2(g)+O3(g) ![]() N2O5(g)+O2(g),0~3s內,反應速率為V(N2O5)=0.2mol·L-1·S-1
N2O5(g)+O2(g),0~3s內,反應速率為V(N2O5)=0.2mol·L-1·S-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不能用離子方程式 CO32﹣+2H+=CO2↑+H2O表示的反應是
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.K2CO3+2HNO3=2KNO3+CO2↑+H2O
C.K2CO3+H2SO4=K2SO4+CO2↑+H2O
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com