
某化學學習小組借助下列裝置(夾持裝置已略)及相關試劑粗略測量空氣中O2的體積百分數。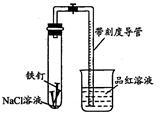
(1)實驗前用堿液清洗鐵釘,再用0.100mol/L的H2SO4溶液浸泡至有氣泡產生。用H2SO4溶液浸泡的目的是_____ 。
(2)為盡量減小誤差,下列操作的正確順序是______ (填序號)。
①裝人鐵釘②插入注射器向鐵釘表面滴入適量 NaCl溶液并打開止水夾③將導管口浸入品紅溶液④塞 上單孔活塞⑤檢查裝置氣密性
(3)實驗中試管內發生的總反應為__ ____ ;用該實驗方案測量空氣中O2的體積百分數時應測量的數據是:①導管與試管內部空間總體積,②______ 。
(4) 實驗時發現上述測量過程因反應較慢耗時較長,對其影響因素作如下分析,請補充 寫出假設三:
假設一:電解質溶液的PH不同
假設二:NaCl溶液的濃度不同
假設三:
(5)借助上述實驗裝置,通過調節溶液的pH驗證假設一,獲得了如下實驗數據:
①當pH=2時,沒有觀察到穩定液柱形成的原因是__ ____
②根據實驗數據分析,為縮短實驗測定時間,pH的最佳范圍是______
③按上述實驗裝置,設計實驗證明假設二。
第一步:___________ ;
第二步::相同溫度下,加入系統表面積的鐵釘,組裝兩套完全相同的上述裝置,分別用注射器將NaCl溶液滴入鐵釘表面;
第三步:記錄形成穩定液柱所用時間和液柱的高度,比較分析數據得出結論。
(1)除去鐵釘表面的鐵銹;
(2)⑤①④②③
(3)4Fe+3O2+6H2O=4Fe(OH)3;吸入導管內的品紅溶液;
(4)鐵釘的表面積(溫度、催化劑)
(5)①溶液的酸性太強,鐵容易發生析氫腐蝕;
②6.0<PH≤6.5
③配置不同濃度的NaCl溶液;
解析試題分析:(1) 鐵釘表面由鐵銹,可以用稀硫酸除去。(2) 試驗裝置裝藥品之前首先要檢驗氣密性,(3) 氯化鈉溶液顯中性,鐵釘在中性溶液中和氧氣發生吸氧腐蝕,總反應為:4Fe+3O2+6H2O=4Fe(OH)3;隨著反應的進行,試管內氧氣減少,壓強降低,在大氣壓的作用下,燒杯中的品紅溶液進入帶刻度導管,反應掉的氧氣等于導管內的品紅溶液的體積(4) 實驗時發現上述測量過程因反應較慢耗時較長,說明反應速率慢,回答問題時應該從影響化學反應速率的因素方面答題;(5)①當pH=2時,溶液顯酸性,鐵釘發生析氫腐蝕,產生氣體,液柱為0;②當PH的范圍為:6.0<PH≤6.5反應的時間最短,產生的液柱最高。③假設二為NaCl溶液的濃度不同,首先要配置不同濃度的NaCl溶液。
考點: 鋼鐵腐蝕 影響化學反應速率的因素


科目:高中化學 來源: 題型:計算題
甲醇可作為燃料電池的原料。以CH4和H2O為原料,通過下列反應來制備甲醇。
I:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.0kJ?molˉ1
CO(g)+3H2(g) △H=+206.0kJ?molˉ1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ?molˉ1
CH3OH(g) △H=-129.0kJ?molˉ1
(1)CH4(g)與H2O(g)反應生成CH3OH(g)和H2(g)的熱化學方程式為 。
(2)將1.0mol CH4和1.0mol H2O(g)通入容積為100 L的反應室,在一定條件下發生反應I,測得在一定的壓強下CH4的轉化率與溫度的關系如圖。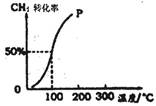
①假設100℃時達到平衡所需構時間為5min,則用H2表示該反應的平均反應速率為 。
②1000C時反應I的平衡常數為 。
(3)在壓強為0.1 MPa、溫度為300℃條件下,將a molCO與2a mol H2的混合氣體在催化劑作用下發生反應II生成甲醇,平衡后將容器舶容積壓縮到原來的1/2,其他條件不變,對平衡體系產生的影響是 (填字母序號)。
| A.平衡常數K增大 | B.正反應速率加快,逆反應速率減慢 |
| C.CH3OH的物質的量增加 | D.重新平衡c(H2)/c(CH3OH)減小 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
氨基甲酸銨(NH2COONH4)是一種白色固體,易分解、易水解,可用做肥料、滅火劑、洗滌劑等。某化學興趣小組模擬制備氨基甲酸銨,并探究其分解反應平衡常數。反應的化學方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。請按要求回答下列問題:
NH2COONH4(s)。請按要求回答下列問題:
(1)請在下圖1方框內畫出用濃氨水與生石灰制取氨氣的裝置簡圖。
(2)制備氨基甲酸銨的裝置如下圖2所示。生成的氨基甲酸銨小晶體懸浮在四氯化碳中。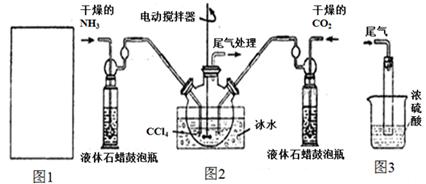
①從反應后的混合物中分離出產品的實驗方法是_____________(填操作名稱)。
②上圖3中濃硫酸的作用是_______________________________________。
(3)將一定量純凈的氨基甲酸銨固體置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡。實驗測得不同溫度下的平衡數據列于下表:
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
下面是某研究小組研究的關于不同催化劑對H2O2分解反應的催化效率。
| 催化劑(0.1g) | 活性炭 | FeCl3 | KI | MnO2顆粒狀 | MnO2粉末狀 |
| 前15s產生氧氣的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s產生氧氣的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s產生氧氣的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s產生氧氣的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為證明化學反應有一定的限度,進行如下探究活動:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.繼續加入2mL CCl4,蓋好玻璃塞,振蕩靜置。
Ⅲ.取少量分液后得到的上層清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至錐形瓶中,加入KSCN溶液用作指示劑,再用c mol/LKI標準溶液滴定,達到滴定終點。重復滴定三次,平均耗用c mol/LKI標準溶液VmL。
(1)探究活動I中發生反應的離子方程式為 。
請將探究活動Ⅱ中“振蕩靜置”后得到下層液體的操作補充完整:將分液漏斗放在鐵架臺上,靜置。
。
(2)探究活動Ⅲ的意圖是通過生成紅色的溶液(假設溶質全部為Fe(SCN)3),驗證有Fe3+殘留,從而證明化學反應有一定的限度,但在實驗中卻未見溶液呈紅色。對此同學們提出了下列兩種猜想:
猜想一:Fe3+全部轉化為Fe2+ 猜想二:生成的Fe(SCN)3濃度極小,其顏色肉眼無法觀察。
為了驗證猜想,查閱資料獲得下列信息:
信息一:乙醚微溶于水,密度為0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可與[Fe(CN)6]4—反應生成暗藍色沉淀,用K4[Fe(CN)6](亞鐵氰化鉀)溶液檢驗Fe3+的靈敏度比用KSCN溶液更高。
結合新信息,現設計以下實驗方案驗證猜想:
①請完成下表
| 實驗操作 | 現象和結論 |
| 步驟一: | 若產生暗藍色沉淀,則 。 |
| 步驟二: | 若乙醚層呈紅色,則 。 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列敘述或表示正確的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,則a+1=b |
| B.用200 mL 4 mol·L-1的NaOH溶液將0.6 mol CO2完全吸收,反應的離子方程式為: 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C.難溶電解質AB2的飽和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,則Ksp值為4xy2 |
| D.常溫下0.1 mol·L-1的醋酸溶液與等濃度等體積NaOH溶液反應后的溶液中: |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列實驗事實所得出的結論中,錯誤的是( )
| A.向AgCl沉淀中滴入稀KI溶液白色沉淀變黃,說明AgI比AgCl更難溶 |
| B.加入鹽酸,產生能使澄清石灰水變渾濁的無色氣體,則試樣中一定有CO32- |
| C.先加入鹽酸無沉淀,再加入BaCl2溶液產生白色沉淀,則試樣中一定有SO42- |
| D.鹽溶液中加入NaOH微熱,產生使濕潤的紅色石蕊試紙變藍的氣體,則一定是銨鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
A.將25℃純水加熱至95℃時,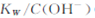 增大 增大 |
B.將pH=11的Na2CO3溶液加水稀釋, 增大 增大 |
| C.室溫下,pH=a的鹽酸與pH=b的氨水等體積混合后pH=7,則a+b="14" |
| D.0.1mol·L-酸HA與0.1mol·L-NaOH溶液等體積混合后pH>7,則 |
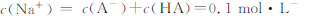
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com