
| 元素性質 | 元素編號 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半徑/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| 最高化合價 | +6 | +5 | +5 | +7 | ||
| 最低化合價 | -2 | -3 | -2 | -3 | -1 | -1 |
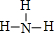
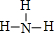
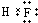
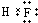
| ||
| △ |
| ||
| △ |
| ||
| 高溫高壓 |
| ||
| 高溫高壓 |
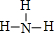 ;
;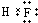 ,
,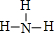 ;
;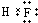 ;
;
| ||
| △ |
| ||
| 高溫高壓 |
| ||
| △ |
| ||
| 高溫高壓 |


科目:高中化學 來源: 題型:
如表是部分短周期元素的原子半徑及主要化合價,根據表中信息,判斷以下敘述正確的是( )
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| 反應時間 | H2O | CO |
| 0 | 1.00 | 1.50 |
| t1 | 0.40 | |
| t2 | 0.90 |
| 0.3 |
| t1 |
| 0.3 |
| t1 |
查看答案和解析>>
科目:高中化學 來源: 題型:


| 高溫 |
| 高溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 乙酸乙酯的實驗室和工業制法常采用如下反應:
乙酸乙酯的實驗室和工業制法常采用如下反應:
| ||
| △ |
| 試劑 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸點(℃) | 34.5 | 78.5 | 117.9 | 77 |
| 同一反應時間 | 同一反應應溫度 | ||||
| 反應溫度/℃ | 轉化率(%) | 選擇性(%)* | 反應時間/h | 轉化率(%) | 選擇性(%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *選擇性100%表示反應生成的產物全部是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化學 來源: 題型:
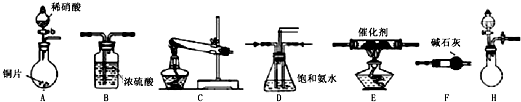
| 試劑組合序號 | 固體試劑 | NH3體積(mL) | |
| a | 6.0g Ca(OH)2(過量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(過量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(過量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com