



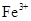 ;2Fe3++Fe=3Fe2+;O2+4e-+2H2O=4OH-
;2Fe3++Fe=3Fe2+;O2+4e-+2H2O=4OH- 。
。

科目:高中化學 來源:不詳 題型:單選題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:推斷題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
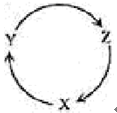
| 選項 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:推斷題
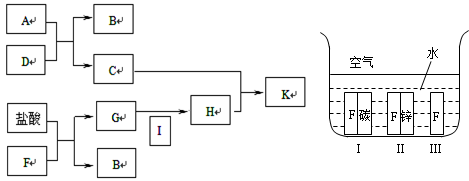
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| 元素 | A | B | C | D |
| 相關 信息 | 其單質是一種本身有毒又可用來消毒的有色氣體 | 其單質既有金屬性,又有一定的非金屬性(但屬于金屬) | 其最外層電子數是電子層數的2倍,且能形成熔點高硬度大的穩定單質 | 其簡單離子核外電子層結構與Ar原子電子層結構相同,單質常出現在火山噴口附近或地殼的巖層里 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com