
【題目】取一定質量的氧化亞銅和氧化銅混合粉末,將其均勻混合后分成兩等份,取其中一份用足量的氫氣還原,測得反應后固體質量減少 6.4g,另一份中加入500mL稀硝酸,固體恰好完全溶解,且同時收集到標準狀況下NO氣體 4.48L,則所用硝酸的物質的量濃度為
A. 3.6mol/LB. 3.2mol/LC. 2.8mol/LD. 2.4mol/L
【答案】B
【解析】
Cu2O和CuO均與氫氣發生置換反應生成Cu和水,則反應后固體質量減少6.40g為O元素的質量,含n(O)=![]() =0.4mol,
=0.4mol,
另一份中加入500mL稀硝酸,固體恰好完全溶解,且同時收集到標準狀況下NO氣體4.48L,只有Cu2O與硝酸發生氧化還原反應,n(NO)=![]() =0.2mol,
=0.2mol,
設每份中Cu2O和CuO的物質的量分別為x、y,由電子守恒及原子守恒可知,![]()
解得x=0.3mol、y=0.1mol,
由銅元素守恒可知n[Cu(NO3)2]=n(CuO)+2n(Cu2O)=0.1mol+0.3mol×2=0.7mol,
由氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,
可知c(HNO3)=![]() =3.2mol/L,
=3.2mol/L,
答案選B。


 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】下列有關物質性質與用途的敘述正確的是( )
A. 濃硫酸具有脫水性,可用作干燥劑
B. NH3極易溶于水,可用作制冷劑
C. 二氧化硫具有漂白性,與氯水混合使用漂白效果更好
D. ClO2具有氧化性,可用于自來水的殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物W、X、Y、Z的分子式均為C7H8,Z的空間結構類似于籃子。下列說法正確的是
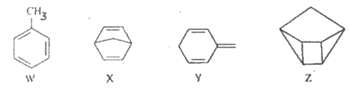
A. Z的一氯代物只有3種
B. 化合物W的同分異構體只有X、Y、Z
C. X、Y、Z均可與酸性KMnO4溶液反應
D. 1molX、1molY與足量Br2/CCl4溶液反應最多消耗Br2均為2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. 用惰性電極電解飽和氯化鈉溶液:2Cl- + 2H+ ![]() H2↑ + Cl2↑
H2↑ + Cl2↑
B. 向Al2(SO4)3溶液中加入過量的NH3·H2O:Al3+ + 4NH3·H2O ═ AlO2-+ 4NH4+ + 2H2O
C. 苯酚鈉溶液中通入少量CO2:CO2 + H2O + 2C6H5O-→ 2C6H5OH + 2 CO32-
D. Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- ═ 5SO42-+ 2Mn2+ + 3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2017年8月3日,中國科學家在《Nature》雜志發表論文,合成了一種代號為ICM-101的高能量密度材料。合成該高能物質的主要原料為草酰二肼,結構簡式如圖所示。下列有關草酰二肼的說法正確的是

A. 可由草酸(HOOC-COOH)和肼(H2N-NH2)發生酯化反應制備
B. 不能發生水解反應
C. 與聯二脲(H2NCONHNHCONH2)互為同分異構體
D. 分子中最多有12個原子處于同一平面(已知NH3分子構型為三角錐)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的值為NA。關于1mol H2O的敘述正確的是
A.含有1mol H2B.含有NA個水分子
C.質量為18 g/molD.在標準狀況下的體積為22.4 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】理論上講,任何自發的氧化還原反應都可以設計成原電池。請利用反應“Cu+2Ag+=2Ag+Cu2+”設計一個化學電池(正極材料用碳棒),回答下列問題:
(1)畫出原電池裝置圖_______,該電池的負極發生_______反應(填“氧化”或“還原”),電解質溶液是_______;
(2)放電時銀離子向__________(填“正極”或“負極”),正極上出現的現象是________。
(3)當反應進行一段時間后取出電極材料,測得某一電極增重了5.4g,則該原電池反應共轉移了電子數目是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在堿性溶液中能大量共存且溶液為無色透明的離子組是( )
A.K+、MnO4-、Na+、Cl-B.Na+、Ca2+、NO3-、HCO3-
C.NH4+、Ba2+、NO3-、SO42-D.K+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現以CO、O2、熔融鹽Z(Na2CO3)組成的燃料電池,采用電解法處理CO同時制備N2O5,裝置如圖所示,其中Y為CO2。下列說法不合理的是( )
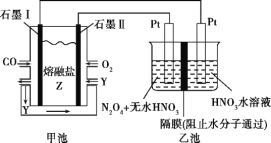
A. 石墨Ⅰ是原電池的負極,發生氧化反應
B. 甲池中的CO32-向石墨Ⅱ極移動
C. 乙池中左端Pt極電極反應式:N2O4-2e-+2HNO3![]() 2N2O5+2H+
2N2O5+2H+
D. 若甲池消耗標準狀況下的氧氣2.24 L,則乙池中產生氫氣0.05 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com