
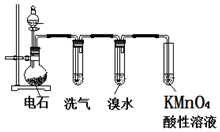
 如圖為實驗室制取乙炔并驗證其性質的裝置圖,回答下列問題:
如圖為實驗室制取乙炔并驗證其性質的裝置圖,回答下列問題: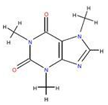 ,實驗室可通過下列簡單方法從茶葉中提取咖啡因:
,實驗室可通過下列簡單方法從茶葉中提取咖啡因: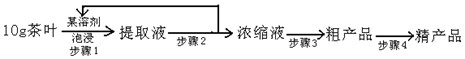
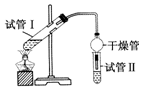
分析 實驗室用電石和水反應制備乙炔,其中含有雜質,為了凈化和檢驗乙炔氣體,測定氣體體積,則需要的裝備依次為:氣體制備裝置、凈化裝置(除硫化氫)、檢驗裝置、性質實驗裝置、排水測體積的裝置,
(1)制備乙炔碳化鈣與水反應很劇烈,用飽和食鹽水可以減緩反應;
(2)實驗室制備乙炔是利用電石和水反應生成乙炔和氫氧化鈣;
(3)電石中含有硫化鈣雜質,所以制備的乙炔氣體中往往含有少量的H2S氣體,會干擾后續檢驗實驗;
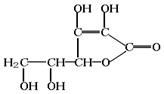
咖啡因易溶于氯仿、乙醇、丙酮及熱苯等,微溶于水、石油醚,則步驟1可加入乙醇等有機溶劑進行萃取,然后進行蒸餾、升華,可得到咖啡因粗產品,
(4)咖啡因易溶于氯仿、乙醇、丙酮及熱苯等,微溶于水、石油醚等,可進行萃取;
(5)分離咖啡因和乙醇,可進行加熱得到濃縮液再結晶(或蒸發)得到粗產品,因咖啡因易升華,為進一步得到較為純凈的咖啡因,可進行升華.
解答 解:(1)實驗室制備乙炔碳化鈣與水反應很劇烈,用飽和食鹽水可以減緩反應,所以為了得到平穩的氣流,用飽和食鹽水代替水,則分液漏斗中盛放的液體是飽和食鹽水,故答案為:飽和食鹽水;
(2)實驗室制備乙炔是利用電石和水反應生成乙炔和氫氧化鈣,反應的化學方程式為:CaC2+2H2O→CH≡CH↑+Ca(OH)2,
故答案為:CaC2+2H2O→CH≡CH↑+Ca(OH)2;
(3)電石中含有硫化鈣雜質,所以制備的乙炔氣體中往往含有少量的H2S氣體,硫化氫氣體具有還原性,也會導致溴水、高錳酸鉀溶液褪色,所以洗氣中應選CuSO4溶液或NaOH溶液除去乙炔中的硫化氫;故答案為:CuSO4溶液或NaOH溶液;
(4)咖啡因易溶于氯仿、乙醇、丙酮及熱苯等,微溶于水、石油醚,則步驟1可加入乙醇等有機溶劑進行萃取,故答案為:B;
(5)分離咖啡因和乙醇,可進行加熱得到濃縮液再結晶(或蒸發)得到粗產品,因咖啡因易升華,為進一步得到較為純凈的咖啡因,可進行升華,故答案為:結晶(或蒸發).
點評 本題考查乙炔制備、檢驗和物質的分離、提純,為高考常見題型,側重于學生的分析、實驗能力的考查,注意把握題給信息以及實驗流程,掌握實驗基本操作和實驗設計方法是解題關鍵,難度不大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
 NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,根據題意回答下列問題:
NO能引起光化學煙霧,破壞臭氧層.處理NO有多種方法,根據題意回答下列問題:| 時間(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子數:N2<O2 | B. | 氣體摩爾體積:N2<O2 | ||
| C. | 氣體的壓強:N2<O2 | D. | 體積:N2<O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其中氮的化合價為-2.
,其中氮的化合價為-2.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室制備乙酸乙酯的化學方程式如下:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業.實驗室制備乙酸乙酯的化學方程式如下:CH3COOH+C2H5OH$?_{△}^{濃H_{2}SO_{4}}$CH3COOC2H5+H2O| 實驗編號 | 試管Ⅰ中試劑 | 試管Ⅱ中試劑 | 測得有機層的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1濃H2SO4 | 飽和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 當X是鹽酸時,則F是稀硝酸24 | |
| B. | 當X是氫氧化鈉時,則F是稀硝酸y | |
| C. | 當X是氫氧化鈉時,B跟Cl2反應可能有白煙現象e | |
| D. | 當X是氫氧化鈉時,B能使酸性高錳酸鉀溶液褪色N |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
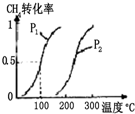 甲醇被稱為21世紀的新型燃料,工業上用CH4和H2O為原料通過下列反應①和②,
甲醇被稱為21世紀的新型燃料,工業上用CH4和H2O為原料通過下列反應①和②,| 實驗編號 | T(°C) | n(CO)/n(H2) | p(MPa) |
| Ⅰ | 150 | 1/3 | 0.1 |
| Ⅱ | 5 | ||
| Ⅲ | 350 | 5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com