
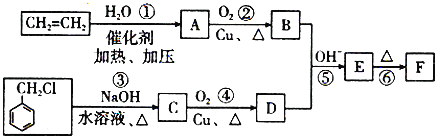
【題目】肉桂醛F(![]() )在自然界存在于桂油中,是一種常用的植物調味油,工業上主要是按如下路線合成的:
)在自然界存在于桂油中,是一種常用的植物調味油,工業上主要是按如下路線合成的:
已知兩個醛分子在NaOH溶液作用下可以發生反應,生成一種羥基醛:
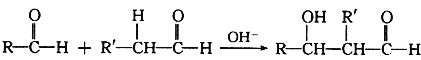
請回答:
(1)D的結構簡式為______.
(2)反應①~⑥中屬于加成反應的是______(填序號).
(3)寫出有關反應③的化學方程式:___________.
(4)在實驗室里鑒定![]() 分子中的氯元素時,是將其中的氯元素轉化為AgCl白色沉淀來進行的,其正確的操作步驟是______(請按實驗步驟操作的先后次序填寫序號).
分子中的氯元素時,是將其中的氯元素轉化為AgCl白色沉淀來進行的,其正確的操作步驟是______(請按實驗步驟操作的先后次序填寫序號).
A.滴加AgNO3溶液B.加NaOH溶液C.加熱D.用稀硝酸酸化
(5)E物質的同分異構體有多種,其中符合條件:苯環上有兩個取代基,其中一個是羧基的為:______(寫出其中一種同分異構體的結構簡式即可).
 口算題卡加應用題集訓系列答案
口算題卡加應用題集訓系列答案科目:高中化學 來源: 題型:
【題目】某校同學在實驗室中對一氧化碳與硫酸鈣反應進行了探究。回答下列問題:
(1)甲組同學利用CaSO4·2H2O在400--500℃脫水制取無水CaSO4。實驗中需用到的加熱裝置中的硅酸鹽質的儀器除玻璃棒外,還用到______________。
(2)乙組同學利用H2C2O4·2H2O在濃硫酸作用下脫水生成CO、CO2并制備純凈的CO氣體,實驗裝置如下:
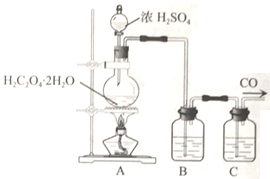
B、C中盛放的試劑依次為______、____________。
(3)丙組同學利用甲組制得的無水CaSO4和乙組制得的CO并利用下列裝置驗證反應并檢驗氣態產物中有SO2和CO2產生。
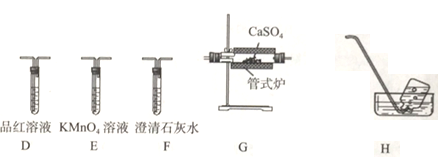
①上述裝置(部分裝置可重復使用)的連接順序為C→___________。
②若E溶液褪色,則發生反應的離子方程式為_____________。
③能證明有CO2的生成的實驗依據是____________。
④若G中產物為CaO,則G中發生反應的化學方程式為_________________。
(4)丁組的同學取丙組實驗后G裝置中的固體產物加入試管中,然后加人足量稀鹽酸,固體完全溶液且產生少量氣體,通入CuSO4溶液有黑色沉淀。可驗證CO與CaSO4在高溫下還發生了一個副反應,該反應為______________(用方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)既可以作氧化劑又可以作還原劑,當它在反應中作氧化劑時,可能生成的產物是( )
A.N2B.N2O3C.HNO3D.NO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對教材中有關數據的敘述不正確的是![]()
![]()
A. 利用沸點數據可以推測將一些液體混合物分離開來的可能性
B. 通過比較溶度積常數![]() 與溶液中有關離子濃度冪的乘積--離子積
與溶液中有關離子濃度冪的乘積--離子積![]() 的相對大小,可以判斷難溶電解質在給定條件下能否生成或溶解
的相對大小,可以判斷難溶電解質在給定條件下能否生成或溶解
C. 利用溶液的pH與7的大小關系,可以判斷任何溫度下溶液的酸堿性
D. 根據分散質粒子直徑的大小,可以判斷分散系的類別
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容。 據此下列說法錯誤的是
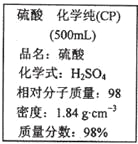
A. 該硫酸具有強烈的腐蝕性,應放于危險化學用品柜中妥善保管
B. 取10 mL該硫酸于燒杯中,再加等體積的水,可配得49%的硫酸
C. 配制200mL4.6 mol·L-1的稀硫酸需取該硫酸50 mL
D. 該硫酸與等質量的水混合所得溶液的物質的量濃度小于9.2 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列式子屬于水解反應,且溶液呈酸性的是 ( )
A. HCO3- + H2O ![]() H3O+ + CO32- B. Fe3+ + 3H2O
H3O+ + CO32- B. Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C. HS- + H2O ![]() H2S + OH- D. NH4+ + OH-
H2S + OH- D. NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.汽車尾氣排放的NOX和CO污染環境,在汽車尾氣系統中安裝催化轉化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列問題:
(1)CO的燃燒熱為___________,若1molN2(g)、1molO2(g)分子中化學鍵斷裂時分別需要吸收946kJ、498kJ的能量,則1molNO(g)分子中化學鍵斷裂時需吸收的能量為___________kJ。
(2)為了模擬反應2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化轉化器內的工作情況,控制一定條件,讓反應在恒容密閉容器中進行,用傳感器測得不同時間NO和CO的濃度如表:
2CO2(g)+N2(g)在催化轉化器內的工作情況,控制一定條件,讓反應在恒容密閉容器中進行,用傳感器測得不同時間NO和CO的濃度如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s內的平均反應速率v(N2)___________。
②能說明上述反應達到平衡狀態的是___________。
A.2n(CO2)=n(N2) B.混合氣體的平均相對分子質量不變
C.氣體密度不變 D.容器內氣體壓強不變
(3)在某恒容容器中發生下列反應:2NO2(g)![]() 2NO(g)+O2(g),將一定量的NO2放入恒容密閉容器中,測得其平衡轉化率隨溫度變化如圖所示。
2NO(g)+O2(g),將一定量的NO2放入恒容密閉容器中,測得其平衡轉化率隨溫度變化如圖所示。

該反應為___________反應(填“吸熱”或“放熱”),已知圖中a點對應溫度下,NO2的起始壓強P0為120kPa,計算該溫度下反應的平衡常數Kp的值為___________。(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
Ⅱ.N2H4-O2燃料電池是一種高效低污染的新型電池,其裝置如圖所示:
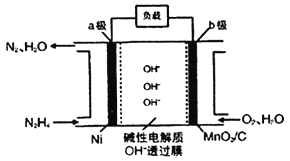
N2H4的電子式為___________;a極的電極反應方程式為___________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z原子序數依次增大,甲、乙、丙、丁均是由前3種元素組成的二元“10電子”微粒,能發生如圖轉化,Z的原子半徑是所有短周期主族元素中最大的,下列說法錯誤的是
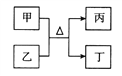
A. 原子半徑大小:W<Y<X<Z
B. W、X、Y三種元素形成的化合物水溶液一定顯酸性
C. W、X、Y與Z均能形成離子化合物
D. Y分別與其他三種元素至少可以形成兩種化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值。下列說法正確的是
A. 標準狀況下,2.24L三氯甲烷中所含分子數為NA
B. 1molH2與1molI2(g)于密閉容器中反應,生成的H-I鍵數為2NA
C. 常溫下,0.1molFe投入到足量濃硫酸中反應,轉移的電子數為0.3NA
D. 8.8g乙酸乙酯和乙醛(CH3CHO)的混合物中含有的C原子數為0.4NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com