
分析 恒溫、恒容的密閉容器,
狀態Ⅰ:3A(g)+2B(g)?xC(g)+yD(g)
起始量 3mol 2mol
狀態Ⅱ:3A(g)+2B(g)?xC(g)+yD(g)
起始 0.6mol 0.4mol 4mol 0.8mol
說明為完全等效平衡,按化學計量數轉化到左邊,滿足n(A)=3mol、n(B)=2mol;另外,如果反應前后氣體的總計量數相等,即x+y=3+2=5時,也是等效平衡.
解答 解:由題意可知恒溫、恒容的密閉容器,
狀態Ⅰ:3A(g)+2B(g)?xC(g)+yD(g)
起始量 3 2 0 0
狀態Ⅱ:3A(g)+2B(g)?xC(g)+yD(g)
起始 0.6 0.4 4 0.8
兩種狀態下到平衡時混合氣體中C的體積分數均為m%,說明兩個平衡為完全等效平衡,按化學計量數轉化到左邊,應該滿足:n(A)=3mol、n(B)=2mol,則:0.6+0.6+$\frac{12}{x}$=3,0.4+$\frac{1.6}{y}$=2,解得x=5;y=1;
另外,對于反應前后氣體的計量數之和相等的反應,物質的投料呈相同比例時也是等效平衡,所以x+y=5也是正確的,
故答案為:5;1;或者滿足x+y=5.
點評 本題考查化學平衡計算、等效平衡等,題目難度中等,理解等效平衡規律為解答本題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | ②⑤ | B. | ⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
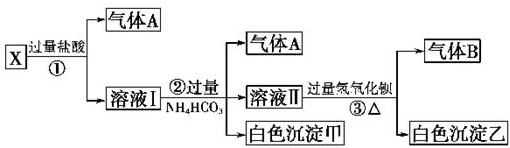
 ,已知斷裂1mol B-B鍵吸收167kJ的熱量,生成1mol B≡B鍵放出942kJ熱量.試判斷相同條件下B4與B2的穩定性順序是:N4<N2.
,已知斷裂1mol B-B鍵吸收167kJ的熱量,生成1mol B≡B鍵放出942kJ熱量.試判斷相同條件下B4與B2的穩定性順序是:N4<N2.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:W>Y>Z,而離子半徑:Z>Y>W | |
| B. | 化合物丙中只存在共價鍵 | |
| C. | 測得丙的水溶液呈酸性,則溶液中丙鹽陽離子濃度大于酸根離子濃度 | |
| D. | 甲沸點遠高于乙,可能是甲分子存在氫鍵所致 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
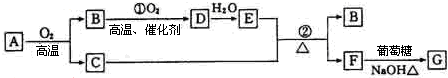
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
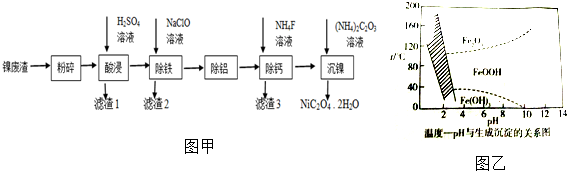
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
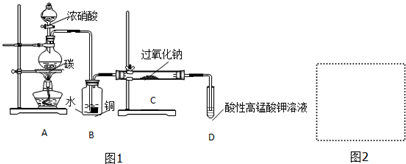

| 滴定次數 | 1 | 2 | 3 | 4 |
| KMnO4溶液體積/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用濕潤的紅色石蕊試紙檢驗某種氣體是否是NH3 | |
| B. | 某種有色溶液可使淀粉-KI試紙變藍色,則該溶液中可能含有Fe3+ | |
| C. | 用玻璃棒蘸取溶液點在用蒸餾水濕潤過的pH試紙上可測量該溶液的pH | |
| D. | 將濕潤的藍色石蕊試紙片粘在玻璃棒上置于氯氣中,試紙先變紅后褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com