
【題目】已知NaHSO3溶液呈弱酸性。在0.1mol/L NaHSO3溶液中,下列粒子濃度關系式不正確的是( )
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2SO3)
)>c(H2SO3)
B.c(H+)+c(![]() )=c(OH-)+c(H2SO3)
)=c(OH-)+c(H2SO3)
C.c(Na+)=c(![]() )+c(H2SO3)+c(
)+c(H2SO3)+c(![]() )
)
D.c(H+)+c(Na+) =c(OH-)+c(![]() )+2c(
)+2c(![]() )
)
 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:
【題目】化學上常用燃燒法確定有機物的組成。這種方法是在電爐加熱時用純氧氧化管內樣品,根據產物質量確定有機物的組成,裝置如下圖所示,是用燃燒法確定有機物化學式常用的裝置。產生的氧氣按從左到右流向各導管的連接順序為g-f,e-h , i-c , d-a。

回答下列問題:
(1)C裝置中濃H2SO4的作用______________________________________。
(2)D裝置中MnO2的作用為________________________。
(3)E中CuO的作用為_____________________。
(4)若準確稱取0.90 g樣品(只含C、H、O三種元素中的兩種或三種)經充分燃燒后,A管質量增加1.32 g,B管質量增加0.54 g,則該有機物最簡式為______________,若此有機物的相對分子質量為90,則其分子式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃ 時,向體積均為20mL、濃度均為0.1000mol·L-1的三種酸HX、HY、HZ溶液中分別逐滴加入0.1000mol·L-1的NaOH溶液,所得溶液的pH與加入NaOH溶液的體積關系如圖所示。下列說法正確的是( )
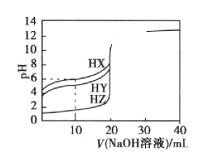
A.當V(NaOH溶液)=0mL時,三種溶液相比較c(X-)>c(Y-)>c(Z-)
B.當三種溶液pH均等于7時,反應消耗的n(HX)>n(HY)>n(HZ)
C.當V(NaOH溶液)=10mL時,反應后溶液中各離子濃度由大到小的順序為c(X-)>c(Y-)>c(Z-)>c(Na+)
D.HY與HZ混合溶液中:c(H+)=c(Y-)+c(Z-)+![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究性學習小組探究與銅有關的物質的性質,過程設計如下:
提出猜想:
問題1:在元素周期表中,銅與鋁的位置很接近,氫氧化鋁具有兩性,氫氧化銅有兩性嗎?
問題2:鐵和銅都有變價,一般情況下,Fe2+的穩定性弱于的Fe3+,Cu+的穩定性也弱于Cu2+嗎?
問題3:硫酸銅溶液呈藍色,銅與濃硝酸常溫下反應生成的溶液也是藍色嗎?
實驗探究:
Ⅰ.解決問題1:
(1)實驗需配制100mL0.50molL-1CuSO4溶液,必需的玻璃儀器有膠頭滴管、燒杯、___、___。
(2)為達到目的,某同學認為只要進行兩次實驗即可得出結論。請寫出實驗②的具體內容。
①向盛有CuSO4溶液的試管中滴加NaOH溶液至過量,觀察生成的Cu(OH)2沉淀是否溶解;
②___。
Ⅱ.解決問題2的實驗和現象如下:
①取一定量制得的氫氧化銅固體,于坩堝中灼燒,當溫度達到80~100℃時得到黑色固體粉末;繼續加熱至1000℃以上,黑色粉末全部變成紅色粉末氧化亞銅;
②取適量紅色氧化亞銅粉末于潔凈試管中,加入過量的稀硫酸,得到藍色溶液,同時觀察到試管底部還有紅色固體存在。根據以上實驗及現象回答下列問題:
(3)寫出氧化亞銅與稀硫酸反應的離子方程式:___。
(4)從實驗中可得出的結論:當溫度在1000℃以上時___(填Cu2+或Cu+,下同)穩定,在酸性溶液中___穩定。
Ⅲ.解決問題3,某同學設計的實驗如下:
取一銅片裝入試管,加入適量的濃硝酸,觀察溶液的顏色變化。
(5)另一同學認為此同學設計的實驗有缺陷,原因是___。
(6)銅與濃硝酸反應溶液呈綠色,有同學認為這是生成的NO2溶于其中的原因。請設計實驗說明此解釋是否正確(只需要寫出一種方法即可)。___
實驗步驟 | 實驗結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T1時,向容積為2L的恒容密閉容器甲、乙中分別充入一定量的CO(g)和H2O(g),發生反應:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H= —41kJ·mol-1。數據如下,下列說法錯誤的是( )
CO2(g)+H2(g) △H= —41kJ·mol-1。數據如下,下列說法錯誤的是( )
容器 | 甲 | 乙 | ||
反應物 | CO | H2O | CO | H2O |
起始時物質的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡時物質的量(mol) | 0.8 | 0.2 | a | b |
A.乙容器中,平衡時,反應放出的熱量為32.8kJB.T1時,反應的平衡常數K乙=1
C.平衡時,乙中CO的濃度是甲中的2倍D.乙容器中,平衡時H2O的轉化率約為75%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】具有抗HIV、抗腫瘤、抗真菌和延緩心血管老化的活性苯并呋喃衍生物(R)的合成路線如下:
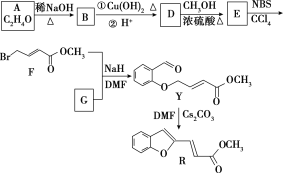
已知:RCHO+R1CH2CHO![]()
![]() +H2O(R、R1表示烴基或氫)
+H2O(R、R1表示烴基或氫)
(1)①A的名稱是________。
②D―→E的反應類型是________。
③F中含有的官能團有酯基、________和________(寫名稱)。
④寫出F與足量NaOH溶液共熱反應的化學方程式___________。
(2)物質G可通過如下流程合成:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
1.08 g的I與飽和溴水完全反應,生成2.66 g白色沉淀,則I的結構簡式為_________寫出M―→G中反應①的化學方程式______________________。
(3)下列說法正確的是________(選填字母)。
a.Y易溶于水
b.B能使酸性高錳酸鉀溶液褪色
c.R的分子式為C12H10O3
d.I與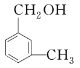 互為同系物
互為同系物
(4)寫出符合下列要求的E的同分異構體的結構簡式:____(寫反式結構)。
①與E具有相同官能團 ②能發生銀鏡反應 ③有2個-CH3 ④存在順反異構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組欲探究Na2CO3和NaHCO3的性質,發現實驗室里盛放兩種固體的試劑瓶丟失了標簽。于是,他們先對固體A、B進行鑒別,再通過實驗進行性質探究。
(1)分別加熱固體A、B,發現固體A受熱產生的氣體能使澄清石灰水變渾濁。A受熱分解的化學方程式為_____。
(2)稱取兩種固體各2g,分別加入兩個小燒杯中,再各加10 mL蒸餾水,振蕩,測量溫度變化;待固體充分溶解,恢復至室溫,向所得溶液中各滴入2滴酚酞溶液。
①發現Na2CO3固體完全溶解,而NaHCO3固體有剩余,由此得出結論_________________。
②同學們在兩燒杯中還觀察到以下現象。其中,屬于盛放Na2CO3的燒杯中出現的現象的是______(填字母序號)。
a.溶液溫度下降 b.溶液溫度升高 c.滴入酚酞后呈淺紅色 d.滴入酚酞后呈紅色
(3)如圖所示,在氣密性良好的裝置Ⅰ和Ⅱ中分別放入藥品,將氣球內的固體同時倒入試管中。

①兩試管中均產生氣體,__________(填“Ⅰ”或“Ⅱ”)的反應程度更為劇烈。
②反應結束后,氣球均有膨脹,恢復至室溫,下列說法正確的是__________。
a.裝置Ⅰ的氣球體積較大
b.裝置Ⅱ的氣球體積較大
c.生成氣體的體積根據鹽酸計算
d.生成氣體的體積根據固體計算
(4)同學們將兩種固體分別配制成0.5 mol·L-1的溶液,設計如下方案并對反應現象作出預測:
實驗方案 | 預測現象 | 預測依據 |
操作1:向2 mLNa2CO3溶液中滴加1mL 0.5mol·L-1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32—濃度較大,能與CaCl2發生反應______________(寫離子方程式) |
操作2:向2 mLNaHCO3溶液中滴加1 mL 0.5mol·L-1CaCl2溶液 | 無白色沉淀 | NaHCO3溶液中的CO32—濃度很小,不能與CaCl2反應 |
實際實驗后,發現操作2的現象與預測有差異:產生白色沉淀和氣體。則該條件下,NaHCO3溶液與CaCl2溶液反應的離子方程式為_______________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com