
【題目】短周期主族元素X、Y、Z、W的原子序數依次增大,P、M、N均是由其中兩種上述元素組成的化合物,它們存在轉化關系Q![]() P+M+N,P能使濕潤的紅色石蕊試紙變藍,M的組成元素位于同一主族,N常溫常壓下為液體。下列說法不正確的是( )
P+M+N,P能使濕潤的紅色石蕊試紙變藍,M的組成元素位于同一主族,N常溫常壓下為液體。下列說法不正確的是( )
A.原子半徑:Y>Z>W>X
B.簡單氣態氫化物的熱穩定性:Z>Y
C.物質M具有漂白性
D.Q既能與強酸溶液反應,又能與強堿溶液反應
【答案】A
【解析】
P能使濕潤的紅色石蕊試紙變藍,則P為氨氣,N常溫常壓下為液體,主族元素形成的化合物,常溫常壓下為液體的常見的是H2O,則已確定三種元素:H、N、O,M為同族元素形成的化合物,則為SO2,則Q為亞硫酸氫銨或亞硫酸銨,受熱分解生成NH3、SO2、H2O。
由分析可知,P為NH3,M為SO2,N為H2O,X、Y、Z、W分別為H、N、O、S。
A.同一周期從左向右原子半徑逐漸減小,同一主族從上到下原子半徑逐漸增大,則原子半徑:S>N>O>H,故A錯誤;
B.非金屬性:O>N,則簡單氣態氫化物的熱穩定性:H2O>NH3,故B正確;
C.M為SO2,具有漂白性,故C正確;
D.Q可能為亞硫酸銨或亞硫酸氫銨,既能與強酸溶液反應,又能與強堿溶液反應,故D正確;
故答案為A。


科目:高中化學 來源: 題型:
【題目】碘酸鉀作為食鹽—碘添加劑,而碘化鉀則是化工生產中一種重要原料。還原法生產碘化鉀是由碘與氫氧化鉀反應生成碘酸鉀后,用甲酸還原而得,其主要流程如圖。
請回答下列問題:
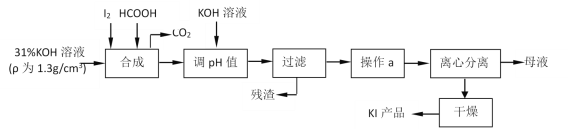
(1)判斷“合成”過程中,碘是否已完全反應的方法是___。
(2)實驗室中,過濾操作要求“一貼二低三靠”,其中“三靠”是指盛有被過濾液體的燒杯注液口緊靠玻璃棒、___、___。
操作a包括“蒸發濃縮、冷卻結晶”是依據KI具有何種性質:___。
(3)寫出“合成”過程中,HCOOH參與的離子反應方程式:___。
(4)測定產品中KI含量的方法是:
a.稱取3.340g樣品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于錐形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3與KI反應完全;
c.以淀粉為指示劑,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液體積平均值為10.00mL。
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-。
①測定過程所需儀器在使用前必須檢查是否漏液的有___。
②該樣品中KI的質量分數為___。(保留3位有效數字)
(5)有學生選用家庭廚房中的有關調料(如黃酒、白醋、醬油、味精等),用簡便方法來檢測是否是加碘食鹽。通過實踐,發現廠商只要在食鹽包裝的封口處夾一條碘化鉀淀粉試紙,并在袋上注明使用方法就能鑒別真偽。現請你寫出檢測使用說明書___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 有機物Y是一種治療心血管和高血壓的藥物,某研究小組以甲苯、乙烯等物質為主要原料,通過以下路線合成:
有機物Y是一種治療心血管和高血壓的藥物,某研究小組以甲苯、乙烯等物質為主要原料,通過以下路線合成:

已知:RX+NaCN![]() RCN
RCN![]() RCOOH
RCOOH

請回答:
(1)Y的化學式為______________
(2)寫出化合物H的結構簡式_______________。
(3)下列說法不正確的是______________。
A.B的一氯代物有三種
B.反應①②③④均屬于取代反應
C.化合物G→Y的轉化過程中,涉及的反應類型有取代反應、加成反應
D.反應①的試劑與條件為Cl2/光照
E. 化合物E能發生銀鏡反應
(4)寫出反應④的化學方程式________________。
(5)芳香族化合物M是B的同分異構體,M含有二個六元環(且兩個二元環共用兩個相鄰的碳原子),則M可能的結構有_______________。(任寫兩種)
(6)已知一個碳原子上連有兩個羥基是不穩定的,會脫水轉化為羰基。:![]() .寫出以
.寫出以![]() 為原料制備合成
為原料制備合成 的線路圖。___________
的線路圖。___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵(![]() )是一種用途廣泛的化工原料,工業上常用廢鐵屑和稀硫酸制備。
)是一種用途廣泛的化工原料,工業上常用廢鐵屑和稀硫酸制備。
實驗室通過圖7裝置模擬其制備過程。請回答下列問題:
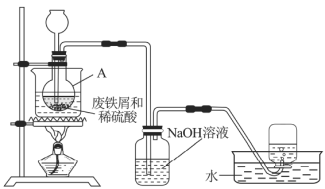
(1)進行實驗之前需檢查整套裝置的______。裝置甲中儀器A的名稱是______,鐵和稀硫酸反應后所得溶液呈______色。
(2)常溫下廢鐵屑和稀硫酸反應較慢,而直接加熱時溫度過高又可能產生![]() 等副產物,因此,采用水浴加熱,并使用過量的
等副產物,因此,采用水浴加熱,并使用過量的![]() 將可能產生的
將可能產生的![]() 還原成
還原成![]() 。
。![]() 還原
還原![]() 的離子方程式為______________。
的離子方程式為______________。
(3)為驗證反應后A中溶液是否含![]() ,取A中少量溶液快速冷卻后,迅速滴入幾滴
,取A中少量溶液快速冷卻后,迅速滴入幾滴![]() 溶液,溶液顏色無明顯變化,說明A中溶液__________(填“含有”或“不含”)
溶液,溶液顏色無明顯變化,說明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)廢鐵屑中含有硫化物雜質,故反應中會生成少量的![]() 氣體。因此,裝置乙中
氣體。因此,裝置乙中![]() 溶液的主要作用是______,裝置丙中集氣瓶收集到的氣體主要是________。
溶液的主要作用是______,裝置丙中集氣瓶收集到的氣體主要是________。
(5)將![]() 廢鐵屑(
廢鐵屑(![]() 單質的質量分數為80%,雜質為
單質的質量分數為80%,雜質為![]() 和
和![]() )與
)與![]() 的
的![]() 溶液充分反應,
溶液充分反應,![]() 的理論產量為____
的理論產量為____![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖中分別是某課外活動小組設計的制取氨氣并用氨氣進行噴泉實驗的兩組裝置,回答下列問題:
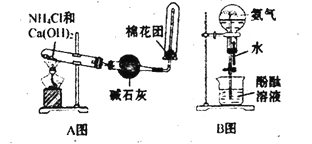
(1)用A圖所示的裝置可制備干燥的NH3,反應的化學方程式為:___。干燥管中干燥劑能否改用無水CaCl2?__。(填“能”或“不能”)檢驗NH3是否收集滿的實驗方法是:__。氨氣溶于水呈堿性的原因是:___。
(2)若要配制100mL9.0mol/L的氨水,用到的玻璃儀器有燒杯、玻璃棒、量筒、___、__。
(3)將等濃度、等體積的氨水和鹽酸混合,所得溶液中離子濃度從大到小的順序為___。
(4)用B圖所示的裝置可進行噴泉實驗,上部燒瓶已充滿干燥氨氣,引發水上噴的操作是__,該實驗的原理是:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛精礦可用于冶煉金屬鉛,其主要成分為PbS。
I.火法煉鉛將鉛精礦在空氣中焙燒,生成PbO和SO2。
①用鉛精礦火法煉鉛的反應的化學方程式為___。
②火法煉鉛的廢氣中含低濃度SO2,可將廢氣通入過量氨水中進行處理,反應的離子方程式為___。
II.濕法煉鉛在制備金屬鉛的同時,還可制得硫磺,相對于火法煉鉛更為環保。濕法煉鉛的工藝流程如圖:

已知:①不同溫度下PbCl2的溶解度如下表所示。

②PbCl2為能溶于水的弱電解質,在Cl-濃度較大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)鉛精礦浸取后“趁熱過濾”的原因是___。
(4)操作a為加適量水稀釋并冷卻,該操作有利于濾液1中PbCl2的析出。試分析“加適量水稀釋”可能的原因是___。
(5)將溶液3和濾液2分別置于如圖所示電解裝置的兩個極室中,可制取金屬鉛并使浸取液中的FeCl3再生。

①溶液3應置于___(填“陰極室”或“陽極室”)中。
②濾液2電解后可實現FeCl3的再生,該電極的電極反應式___。
③若鉛精礦的質量為ag,鉛浸出率為b,當電解池中通過cmol電子時,金屬鉛全部析出,鉛精礦中PbS的質量分數為___(用a、b、c的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三代太陽能電池就是銅銦鎵硒CIGS等化合物薄膜太陽能電池以及薄膜Si系太陽能電池。
(1)晶體硅中Si原子的雜化方式是___,基態Ga原子核外電子排布式為___。
(2)向硫酸銅溶液中逐滴滴加濃氨水,先出現藍色絮狀沉淀,后沉淀逐漸溶解得到[Cu(NH3)4]SO4的深藍色透明溶液。
①NH3極易溶于水,除因為NH3與H2O都是極性分子外,還因為____。
②在[Cu(NH3)4]2+中Cu2+與NH3之間形成的化學鍵稱為___,提供孤電子對的成鍵原子是___。
③[Cu(NH3)4]2+具有對稱的空間構型,[Cu(NH3)4]2+中的兩個NH3被兩個C1-取代,能得到兩種不同結構的產物,則[Cu(NH3)4]2+的空間構型為___。
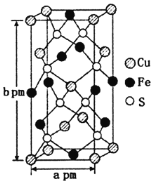
(3)某含銅化合物的晶胞如圖所示,晶胞上下底面為正方形,側面與底面垂直。則晶胞中每個Cu原子與____個S原子相連,含銅化合物的化學式為____。設NA為阿伏加德羅常數的值,則該晶胞的密度為___gcm3(用含a、b、NA的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用反應Cu+2FeCl3=CuCl2+2FeCl2設計成如下圖所示的原電池,回答下列問題:
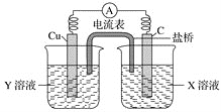
①寫出電極反應式:
正極___________;負極__________。
②圖中X溶液是________,Y溶液是________。
③原電池工作時,鹽橋中的________(填“陽”、“陰”)離子向X溶液方向移動。
(2)控制適合的條件,將反應2Fe3++2I-![]() 2Fe2++I2設計成如圖所示的原電池。
2Fe2++I2設計成如圖所示的原電池。
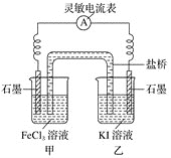
請回答下列問題:
①反應開始時,乙中石墨電極上發生________(填“氧化”或“還原”)反應,電極反應式為________。甲中石墨電極上發生________(填“氧化”或“還原”)反應,電極反應式為______。
②電流表讀數為0時,反應達到平衡狀態,此時在甲中加入FeCl2固體,則乙中的石墨作________(填“正”或“負”)極,該電極的電極反應式為________。
(3)利用反應2Cu+O2+2H2SO4=2CuSO4+2H2O可制備CuSO4,若將該反應設計為原電池,其正極電極反應式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯化亞銅(CuCl)廣泛應用于化工、印染等行業。以硫化銅精礦為原料生產CuCl的工藝如圖:
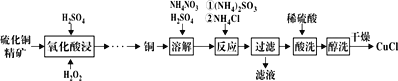
已知CuCl難溶于醇和水,溶于c(Cl-)較大的體系[CuCl(s)+Cl-![]() CuCl2-],潮濕空氣中易水解氧化。
CuCl2-],潮濕空氣中易水解氧化。
(1)“氧化酸浸”前先將銅礦粉碎的目的是__。該過程生成藍色溶液和淺黃色沉淀,則反應的化學反應方程式為__;
(2)“溶解”時所用硫酸濃度為0.3mol·L-1,配制1L此硫酸溶液,需要98%、1.84g·mL-1濃硫酸__mL(保留1位小數)。溶解時反應的離子方程式__;
(3)“反應”時,Cu+的沉淀率與加入的NH4Cl的量關系如圖所示。
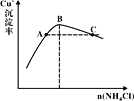
①反應的氧化產物是___,n(氧化劑):n(還原劑)=___;
②比較c(Cu+)相對大小:A點___C點(填“>”、“<”或“=”)。
③提高處于C點狀態的混合物中Cu+沉淀率措施是___;
(4)“過濾”所得濾液中溶質主要成分的化學式為__;
(5)不能用硝酸代替硫酸進行“酸洗”,理由是__。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com