
【題目】已知:CH3-CH=CH2+HBr![]() CH3-CHBr-CH3主要產物
CH3-CHBr-CH3主要產物![]() 。1mol烴A充分燃燒后可以得到
。1mol烴A充分燃燒后可以得到![]() 和
和![]() 。烴A在不同條件下能發生如下圖所示的一系列變化。
。烴A在不同條件下能發生如下圖所示的一系列變化。
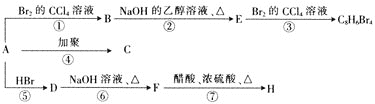
(1)A的結構簡式為______。
(2)上述反應中,①是________反應,⑦是________反應。![]() 填反應類型
填反應類型![]()
(3)寫出C、H的結構簡式:C______________H____________
(4)寫出反應D→F的化學方程式:_____________。
【答案】![]() 加成 酯化或取代
加成 酯化或取代 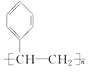

![]() +NaOH
+NaOH ![]()
![]() +NaBr
+NaBr
【解析】
1 mol烴A完全燃燒得8 mol CO2和4 mol H2O,則A的分子式為C8H8。根據流程圖,反應①發生的是A與溴的加成反應,反應②是B(鹵代烴)發生的消去反應,反應③是在E(含有不飽和碳碳鍵)與Br2的加成反應,根據產物中溴原子的數目,說明E中含有碳碳三鍵,則E為:![]() ,B為:
,B為: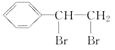 ,A為
,A為![]() ;因此C為:
;因此C為: ,根據題意信息,不對稱烯烴A與HBr加成反應生成D,D為:
,根據題意信息,不對稱烯烴A與HBr加成反應生成D,D為: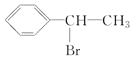 ,則F為:
,則F為: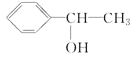 ,H為:
,H為: ,加成分析解答。
,加成分析解答。
(1)根據上述分析, A的結構簡式為![]() ,故答案為:
,故答案為: ![]() ;
;
(2)上述反應中,反應①是加成反應,反應⑦是 與乙酸的酯化反應或取代反應,故答案為:加成;酯化或取代;
與乙酸的酯化反應或取代反應,故答案為:加成;酯化或取代;
(3)由上述分析可知,C為 , H為
, H為 ,故答案為:
,故答案為: ;
;  ;
;
(4)D→F是![]() 在氫氧化鈉水溶液、加熱條件下發生水解反應生成
在氫氧化鈉水溶液、加熱條件下發生水解反應生成![]() ,反應的化學方程式為
,反應的化學方程式為![]() +NaOH
+NaOH ![]()
![]() +NaBr,故答案為:
+NaBr,故答案為:![]() +NaOH
+NaOH ![]()
![]() +NaBr。
+NaBr。


科目:高中化學 來源: 題型:
【題目】一定溫度下,在固定容積為 5L 的密閉容器中發生可逆反應:C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)請寫出該反應的化學平衡常數表達式 K= ________________________ 。
(2)不能判斷該反應一定達到化學平衡狀態的依據是_____________(填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2 的同時消耗 n mol CO
C.容器中混合氣體的密度不隨時間而變化
D.混合氣體的壓強不再變化
(3)若在固定容積為 5L 的密閉容器中加入的是 2 mol Fe(s)與 1 mol H2O(g),發生反應: 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g),△H<0,t1 秒時,H2 的物質的量為 0.2 mol,到 t2 秒時恰好達到平衡,此時 H2的物質的量為 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1 秒時,H2 的物質的量為 0.2 mol,到 t2 秒時恰好達到平衡,此時 H2的物質的量為 0.35 mol。
①t1~t2這段時間內的反應速率υ(H2O)=____;達到平衡時,H2的體積分數為____。
②若繼續加入 2 mol Fe(s),則平衡___________移動(填“向正反應方向”、“向逆反應方向”或“不”),繼續通入1molH2O再次達到平衡后,H2的物質的量為___________。
③該反應的逆反應速率隨時間變化的關系如圖:

t1時改變了某種條件,改變的條件可能是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以MnO2為原料制得的MnCl2溶液中常含有Cu2+、Pb2+等金屬離子,通過添加過量難溶電解質MnS,可使這些金屬離子形成硫化物沉淀,經過濾除去包括MnS在內的沉淀。根據上述實驗事實,下列說法中,不正確的是
A.溶解度 MnS<PbS
B.MnS存在沉淀溶解平衡 MnS(s)![]() Mn2+(aq) + S2-(aq)
Mn2+(aq) + S2-(aq)
C.Cu2+轉化為沉淀的原理為 MnS(s) + Cu2+(aq)=CuS(s) + Mn2+(aq)
D.沉淀轉化能用于除去溶液中的某些雜質離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y、Z的原子序數依次增大。其中X與Y可形成一種淡黃色物質P,常溫下將0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z為金屬元素,且Z可在W的一種氧化物中燃燒,生成一種白色的物質和一種黑色的物質。下列說法錯誤的是()
;Z為金屬元素,且Z可在W的一種氧化物中燃燒,生成一種白色的物質和一種黑色的物質。下列說法錯誤的是()
A. 氫化物的沸點:W<X
B. 簡單離子半徑:X>Y>Z
C. 化合物P中既含有離子鍵又含有共價鍵
D. W、X、Y三種元素形成的物質的水溶液顯堿性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常穩下,某絕熱容器中盛有50mLc(H+)=10-3mol·L-1的HX溶液,向該容器中滴加c(OH-)=10-2mol·L-1的NaOH溶液,滴加過程中混合溶波的溫度(T)與所加溶液體積(V)的關系如圖所示。下列敘述不正確的是
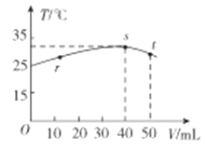
A.s點時:c(Na+)>c(X-)>c(OH-)>c(H+)
B.r→s的過程中,混合溶液中可能存在c(X-)=c(Na+)
C.pH=10的NaX溶液,用蒸餾水稀釋10倍后,溶液的pH>9
D.已知某溫度下CaX2的Ksp=5.3×10-9mol·L-3,在該溫度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高濃度是5.3×10-8mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(結構式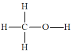 )是一種基礎有機化工原料,應用廣泛。工業上可利用廢氣中的CO2合成CH3OH,發生反應CO2(g)+3H2(g)
)是一種基礎有機化工原料,應用廣泛。工業上可利用廢氣中的CO2合成CH3OH,發生反應CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反應中的相關化學鍵鍵能數據如下:
化學鍵 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H鍵比氫氣中H-H鍵____(填“強”或“弱”)。相同條件下該反應的正反應活化能Ea(正)=210 kJ·mol-1,則逆反應活化能Ea(逆)=______kJ·mol-1。
(2)在1 L恒容密閉容器中充入CO2和H2,所得實驗數據如下表
實驗編號 | 溫度/。C | 起始時物質的量/mol | 平衡時物質的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
實驗①平衡常數K=______,若在該溫度下起始時加入二氧化碳、氫氣、甲醇氣體和水蒸氣各0.10 mol,這時反應向________移動(填“正反應方向”、“逆反應方向”或“不”),判斷理由是______。
實驗②達到平衡時H2轉化率為____。
實驗③a=_________。
(3)甲醇、空氣和稀硫酸可以形成燃料電池,其正極電極反應式為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂、鋁、鐵是三種重要金屬,它們的單質和化合物應用十分廣泛。回答下列問題:
(1)鎂、鋁第一電離能大小的關系是I1(Mg)_________I1(Al),金屬鎂、鋁熔點大小關系是Mg_________Al。(填“大于”、“等于”或“小于”)
(2)氯化鋁加熱時易升華,實驗測得鋁元素與氯元素形成化合物的實際組成為Al2Cl6,其結構簡式如圖所示。其中處于中間的Al原子雜化軌道類型為_________雜化,分子中所有原子_________(能、不能)在同一平面上。
![]()
(3)硝酸鐵和尿素在乙醇中生成[Fe(H2NCONH2)6](NO3)3三硝酸六尿素合鐵![]() 。產物是一種重要的配合物,用作有機鐵肥,簡稱鐵氮肥。基態Fe3+的核外電子排布式為____________。尿素分子中
。產物是一種重要的配合物,用作有機鐵肥,簡稱鐵氮肥。基態Fe3+的核外電子排布式為____________。尿素分子中![]() 鍵與
鍵與![]() 鍵的數目之比為_______。NO3-的空間構型為_________,經測定N2O5晶體中存在NO2+和NO3-,NO2+中氮原子為_________雜化。
鍵的數目之比為_______。NO3-的空間構型為_________,經測定N2O5晶體中存在NO2+和NO3-,NO2+中氮原子為_________雜化。
(4)碳溶解在γ-Fe中形成的一種間隙固溶體,無磁性,其晶胞為面心立方結構,如圖所示。晶體中與相鄰鐵原子距離相等且最近的鐵原子有________個,該物質的化學式為_________。若晶體密度為dg/cm3,則晶胞中最近的兩個碳原子的距離為___________pm(阿伏加德羅常數的值為NA表示,寫出簡化后的計算式即可)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的敘述,正確的是( )
A. 與
與 互為同分異構體
互為同分異構體
B.O2和O3互為同位素
C.苯乙烯(![]() )所有原子一定在同一平面上
)所有原子一定在同一平面上
D.H2O和D2O化學性質相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有些特殊的鋼中含有Fe、C、Mn、V等元素,其中Mn、Fe均為第四周期過渡元素,兩元素的部分電離能數據如下表:
元素 | Mn | Fe | |
電離能(kJ/mol) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列問題:
(1)Mn元素基態原子的價電子排布圖為________。比較錳和鐵兩元素的電離能I2和I3可知,氣態Mn2+再失去一個電子比氣態Fe2+再失去一個電子難。對此,你的解釋是:________________。
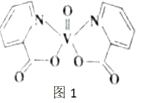
(2)釩元素的某種配合物可增強胰島素降糖作用,它是電中性分子,結構如圖1。分子中采取sp2雜化的原子有_________,1mol分子中含有配位鍵的數目是_____。
(3)鐵元素廣泛應用,Fe2+與KCN溶液反應得Fe(CN)2沉淀,KCN過量時沉淀溶解,生成黃血鹽,其配離子結構如圖![]() 離子所帶電荷未標出
離子所帶電荷未標出![]() 。
。
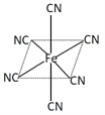
①已知CN-與N2結構相似,CN-的電子式是___________。
②化合物Fe(CO)5熔點為253K,沸點為376K,其固體屬于____晶體。
③寫出沉淀溶解的化學方程式_______________________________。
④圖2的甲是Fe的一種晶胞,晶胞中Fe的堆積方式為___________,己知該晶體的密度為ρg/cm3用NA表示阿伏加德羅常數的值,則該晶胞的邊長為___________cm。
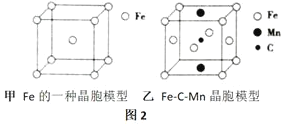
⑤圖2的乙是Fe-C-Mn合金(晶體有缺陷)的一種晶胞,則與C原子等距緊鄰Fe的個數為____________,該合金的化學式為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com