
【題目】某原電池裝置如圖所示,電池總反應為2Ag+Cl2═2AgCl(忽略溶液體積變化)下列關于該電池裝置工作時的說法正確的是( )
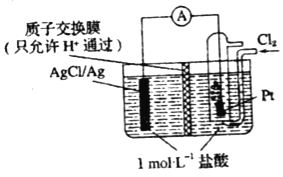
A.H+向左側遷移
B.若有11.2L氯氣(標準狀況)參與反應,左側電極質量增加71 g
C.左側電極區反應為Ag﹣e﹣═Ag+
D.若把質子交換膜換成陰離子交換膜,一段時間右側c(HCl)幾乎不變
【答案】D
【解析】
電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,負極反應式為Cl-+Ag-e-=AgCl↓,正極反應式為Cl2+2e-═2Cl-,以此解答該題。
A.原電池中陽離子移向正極,H+向右側遷移,故A錯誤;
B.若有11.2L氯氣(標準狀況)參與反應,物質的量為![]() 0.5mol,Cl2+2e-=2Cl-,電子轉移1mol,負極反應式為Cl-+Ag-e-=AgCl↓,左側電極質量增加35.5g,故B錯誤;
0.5mol,Cl2+2e-=2Cl-,電子轉移1mol,負極反應式為Cl-+Ag-e-=AgCl↓,左側電極質量增加35.5g,故B錯誤;
C.負極反應式為Cl-+Ag-e-=AgCl↓,故C錯誤;
D.放電時,當電路中轉移amol e-時,交換膜左則會有amol氫離子通過陽離子交換膜向正極移動,同時會有amol Ag失去amol電子生成銀離子,銀離子會與氯離子反應生成氯化銀沉淀,所以氯離子會減少amol,則交換膜左側溶液中約減少2amol離子,如果換成陰離子交換膜,由于氯離子可以向左遷移,且右室氯離子的生成量與向左室的遷移量、左室的消耗量均相等,故c(HCl)幾乎不變,故D正確;
故選:D。


 優百分課時互動系列答案
優百分課時互動系列答案 開心蛙狀元作業系列答案
開心蛙狀元作業系列答案科目:高中化學 來源: 題型:
【題目】AgI可用于人工降雨。AgI溶于水,溶液中離子濃度與溫度的關系如圖所示,已知:pAg=-lgc(Ag+),pI=-lgc(I-)。下列說法正確的是( )
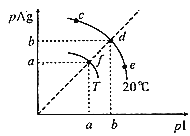
A.圖象中,T<20℃
B.AgI的溶度積Ksp(AgI):c=d=e<f
C.20℃時,AgI粉末溶于飽和KI溶液中c(Ag+)=1×10-bmolL-1
D.在d點飽和AgI溶液中加AgNO3粉末,d點移動到f點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是過渡金屬元素,可以形成多種化合物。
(1)CuCl的鹽酸溶液能夠與CO發生反應:CuCl+CO+H2O=Cu(CO)Cl·H2O
①電負性:C ______O(填“>”或“=”或“<”)。
②CO常溫下為氣體,固態時屬于 晶體。
(2)Cu+與NH3形成的配合物可表示成[Cu(NH3)n]+,該配合物中,Cu+的4s軌道及4p通過sp雜化接受NH3提供的電子對。
[Cu(NH3)n]+ 中Cu+ 與n個氮原子的空間結構呈 型,n= 。
(3)CuCl2溶液與乙二胺(H2N—CH2—CH2—NH2)可形成配離子[Cu(En)2]2+(En是乙二胺的簡寫):

請回答下列問題:
①配離子[Cu(En)2]2+的中心原子基態第L層電子排布式為 。
②乙二胺分子中氮原子軌道的雜化類型為 ,乙二胺和三甲胺[N(CH3)3]均屬于胺,但乙二胺比三甲胺的沸點高的多,原因是: 。
③配合物[Cu(En)2]Cl2中不存在的作用力類型有 (填字母);
A 配位鍵 B 極性鍵 C 離子鍵 D 非極性鍵 E.氫鍵 F.金屬鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某種有機物分子的球棍模型。圖中的“棍”代表單鍵或雙鍵,不同大小的“球”代表三種不同的短周期元素的原子。對該有機物的敘述錯誤的是( )
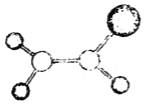
A.該有機物的分子式可能為C2HCl3
B.該有機物分子中的所有原子在同一平面上
C.該有機物無相同官能團同分異構體
D.該有機物可以和氫氣發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)Fe3+的電子排布式是_____________________________________________
(2)下列物質中既有離子鍵又有共價鍵的是________。
A.MgO B.NaOH C.CaCl2 D.CO2
(3) 關于下列分子的說法不正確的是________。
A.既有σ鍵又有π鍵
B.O—H鍵的極性強于C—H鍵的極性
C.是極性分子
D.該物質的分子之間不能形成氫鍵,但它可以與水分子形成氫鍵
(4)下列說法正確的是________。
A.HOCH2CH(OH)CH2OH與CH3CHClCH2CH3都是手性分子
B.NH3和CH4的空間構型相似
C.BF3與![]() 都是平面型分子
都是平面型分子
D.CO2和H2O都是直線型分子
(5)下列有關性質的比較,正確的是________。
A.第一電離能:O>N
B.水溶性:CH3CH2OH>CH3OCH3
C.沸點:H2S>H2O
D.晶格能:NaCl>MgO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳和硫是高中化學學習的兩種重要非金屬元素
(1)下列C原子的電子排布式表達的狀態中能量最高的是_____。
A 1s22s22p2 B.1s22s22px12py1 C.1s22s22px12pz1 D.1s22s12px12py12pz1
(2)硫有一種結構為![]() 的分子(灰球代表硫原子)。其中硫原子雜化方式為_____。
的分子(灰球代表硫原子)。其中硫原子雜化方式為_____。
(3)Fe(CO)5可用作催化劑、汽油抗爆劑等,其分子中σ鍵和π鍵的數目之比為_____。
(4)已知CS2晶體結構類似于干冰。CS2晶體中與每個CS2分子距離最近且等距的CS2分予有_____個。推測CS2晶體密度與冰的晶體密度較大的為_____。可能的原因是_____。又知CS2晶體中晶胞參數是apm,NA表示阿佛加德羅常數的值,晶體密度為_____g/cm3(用含a、NA等符號的表達式表示)。
(5)Na2S是高子晶體,其晶格能可通過圖的Born﹣Haber循環計算得到。
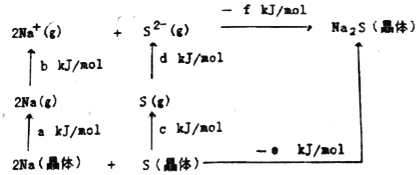
由此可知,Na原子的第一電離能為_____kJ/mol,Na2S的晶格能為_____kJ/mol。(用圖中給出的符號作答)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種元素均位于周期表的前四周期,且原子序數依次增大。元素A是原子半徑最小的元素;B元素基態原子的核外電子分占四個原子軌道;D元素原子的已成對電子總數是未成對電子總數的3倍;E與D處于同一主族;F位于ds區,且原子的最外層只有1個電子。
(1)F原子的電子排布式是______________。
(2)B、C、D元素的第一電離能由大到小的順序是(用元素符號表示)__________________。
(3)B、C元素的某些氫化物的分子中均含有18個電子,則B的這種氫化物的化學式是____________;B、C的這些氫化物的沸點相差較大的主要原因是_______________。
(4)A、B、D可形成分子式為A2BD的某化合物,則該化合物分子中B原子的軌道雜化類型是______________;1 mol該分子中含有π鍵的數目是____________。
(5)寫出兩種與D3分子互為等電子體的微粒_________。
(6)由A、D、E三種元素組成的兩種常見化合物酸性由強到弱為__________,其原因是_________。
(7)C、F兩元素形成的某化合物的晶胞結構如右圖所示,則該化合物的化學式是__________________,C原子的配位數是__________________。
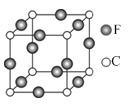
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CaCO3廣泛存在于自然界,是一種重要的化工原料。大理石主要成分為CaCO3,另外有少量的含硫化合物。實驗室用大理石和稀鹽酸反應制備CO2氣體。下列裝置可用于CO2氣體的提純和干燥。完成下列填空:
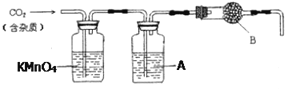
(1)用濃鹽酸配制1:1(體積比)的稀鹽酸(約6 mol·L-1),需要的玻璃儀器有___________
(2)上述裝置中,A是___________溶液,其作用是___________ 。
(3)上述裝置中,B物質是___________。
(4)一次性飯盒中石蠟和CaCO3在食物中的溶出量是評價飯盒質量的指標之一,測定溶出量的主要實驗步驟設計如下:剪碎、稱重→浸泡溶解→過濾→殘渣烘干→冷卻、稱重→恒重
①從物質分類的角度分析,石蠟屬于有機物中的____________類,為了將石蠟從飯盒中溶出,應選用下列試劑中的__________。
a.氯化鈉溶液 b.稀醋酸 c.稀硫酸 d 正已烷
②飯盒中的碳酸鈣常用稀醋酸將其溶出,試寫出其反應的離子方程式__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式正確的是( )
A.氯氣溶于水:Cl2+H2OH++Cl-+HClO
B.金屬鋁溶于氫氧化鈉溶液:Al+2OH-=AlO2-+H2↑
C.苯酚鈉溶液中通入少量二氧化碳:2C6H5O-+CO2=2C6H5OH+CO32-
D.實驗室制備氫氧化鐵膠體:Fe3++3H2O=Fe(OH)3(膠體)+3H+
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com